
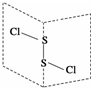
 S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )
S2Cl2是广泛用于橡胶工业的硫化剂;其分子结构如图所示.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中错误的是( )| A. | S2Cl2的电子式为 | |
| B. | S2Cl2为含有极性键和非极性键的非极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔、沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2与H2O反应有SO2生成 |
分析 A.根据结构式知,该分子中每个氯原子和S原子之间形成一个共用电子对、S原子之间形成一个共用电子对,所以每个原子都达到8电子稳定结构;
B.同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,正负电荷重心重合的分子为非极性分子;
C.分子晶体熔沸点与相对分子质量成正比;
D.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,说明生成二氧化硫.
解答 解:A.根据结构式知,该分子中每个氯原子和S原子之间形成一个共用电子对、S原子之间形成一个共用电子对,所以每个原子都达到8电子稳定结构,则该分子电子式为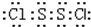 ,故A正确;
,故A正确;
B.S-Cl原子之间存在极性键、S-S原子之间存在非极性键,该分子中正负电荷重心不重合,所以是极性分子,故B错误;
C.分子晶体熔沸点与相对分子质量成正比,S2Br2、S2Cl2都是分子晶体,且相对分子质量S2Br2>S2Cl2,所以熔沸点S2Br2>S2Cl2,故C正确;
D.常温下,S2Cl2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,说明生成二氧化硫,该反应方程式为2S2Cl2+2H2O═SO2↑+3S↓+4HCl,故D正确;
故选B.
点评 本题考查电子式、分子极性、熔沸点高低判断、氧化还原反应等知识点,综合性较强,知道分子晶体熔沸点高低影响因素,易错选项是B,注意该分子结构特点,不是直线形分子,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 电路中流过0.05mol电子 | B. | 溶液中c(Cu2+)降低 | ||
| C. | 电解质溶液质量减少 | D. | 阳极铜消耗了1.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取5.26mL稀硫酸 | |
| B. | 用托盘天平称量11.7g氧化铜粉末 | |
| C. | 用广泛pH试纸测得某溶液的pH为3.5 | |
| D. | 用酸式滴定管量取10.5mL盐酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g Mg与Cl2完全反应,失去电子的数目为0.2NA | |
| B. | 标准状况下,NA个SO3分子所占的体积约为22.4L | |
| C. | 1mol Cl2与H2完全反应,转移的电子数目为NA | |
| D. | CO2的摩尔质量等于NA个CO2分子的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com