
【题目】室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在合适的反应条件下,它们可以按下面的框图进行反应。又知E溶液是无色的。
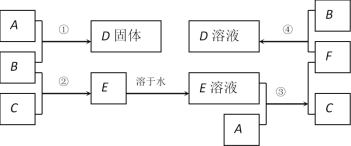
请回答:
(1)写出A、B、C的化学式。A:___________________ B:___________________ C:____________________
(2)反应①的化学方程式为:________________________________________________
(3)反应③的化学方程式为:________________________________________________
(4)反应④的离子方程式为:________________________________________________
【答案】Fe Cl2 H2 ![]() Fe +2HCl = FeCl2 + H2↑ 2Fe2+ +Cl2 = 2Fe3+ +2Cl-
Fe +2HCl = FeCl2 + H2↑ 2Fe2+ +Cl2 = 2Fe3+ +2Cl-
【解析】
单质B为黄绿色气体,可知B为Cl2,C为单质气体,B与C反应生成E,E溶液是无色的,则C为H2,E为HCl,A与盐酸生成氢气,A应为金属固体单质,A与盐酸反应后生成F为A的氯化物,F又能与氯气反应生成D,且A与氯气可以直接生成D,可推知A为Fe,根据转化关系可知,F为FeCl2,D为FeCl3,结合物质的相关性质解答该题;
(1)由以上分析可知,A为Fe,B为Cl2,C为H2,故答案为:Fe,Cl2,H2;
(2)反应①为Fe和Cl2的反应,反应的化学方程式为:![]() ;故答案为:
;故答案为:![]() ;
;
(3)反应③为Fe和HCl的反应,反应的离子方程式为Fe+2HCl=FeCl2+H2↑,故答案为:Fe+2HCl=FeCl2+H2↑;
(4)反应④为FeCl2和Cl2的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】一种植物生长调节剂的分子结构如下图所示。下列说法不正确的是( )
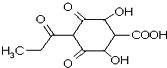
A.该物质含有 3 种官能团
B.该物质属于多官能团化合物
C.该物质属于烃的衍生物
D.该物质属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某地海水中主要离子的含量如表,现利用“电渗析法”进行淡化,技术原理如图所示(两端为惰性电极,阳膜只允许阳离子通过,阴膜只允许阴离子通过)。下列有关说法错误的是( )
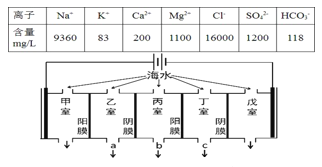
A.甲室的电极反应式为:2Cl--2e-=Cl2↑
B.淡化过程中易在戊室形成水垢
C.乙室和丁室中部分离子的浓度增大,淡水的出口为b
D.通过甲室阳膜的离子的物质的量为2mol时,戊室收集到22.4L(标准状况下)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2X溶液中滴加0.2mol·L-1NaOH溶液,在不同pH环境下不同形态的粒子组成分数如图所示,下列说法正确的是
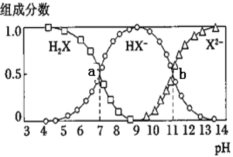
A.水的电离程度:b点小于点a
B.将等物质的量的NaHX、Na2X溶于水中,所得溶液pH恰好为11
C.常温下的Ka(HY)=1.1×10-10,将少量H2X溶液加入到足量NaY溶液中,发生的反应为:H2X+Y-=HY+HX-
D.常温下,反应X2-+H2OHX-+OH-的平衡常数对数值1gK=-11
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中有![]() 、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
、Mg2+ 和Fe2+ 三种离子,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的阳离子是
A.只有![]() B.Mg2+ 、Fe2+C.
B.Mg2+ 、Fe2+C.![]() 、Fe2+D.全部
、Fe2+D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知,四边形![]() 内接于
内接于![]() ,
,![]() ,连接
,连接![]() 、
、![]() 交于点
交于点![]() .
.

(1)如图![]() ,求证:
,求证:![]() ;
;
(2)如图![]() ,过点
,过点![]() 作
作![]() 于点
于点![]() ,若
,若![]() ,求证:
,求证:![]() ;
;
(3)如图![]() ,在(2)的条件下,作
,在(2)的条件下,作![]() ,
,![]() 交
交![]() 于点
于点![]() ,
,![]() 交
交![]() 于点
于点![]() ,且
,且![]() ,若
,若![]() ,
,![]() ,求
,求![]() 的半径.
的半径.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二价铬不稳定, 极易被氧气氧化。醋酸亚铬水合物{ [Cr(CH3COO)2]2·2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水和醚,易溶于盐酸,是常用的氧气吸收剂。实验室中以锌粒、CrCl3溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如下图所示:
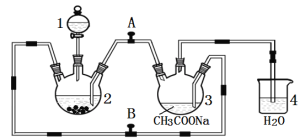
制备过程中发生的反应如下:
Zn(s) + 2HCl(aq) = ZnCl2(aq) + H2(g);
2CrCl3(aq) + Zn(s)= 2CrCl2 (aq) + ZnCl2(aq)
2Cr2+(aq) + 4CH3COO—(aq) + 2H2O(l) = [Cr(CH3COO)2]2·2H2O (s)
请回答下列问题:
(1)仪器1的名称是 , 所盛装的试剂是 。
(2)本实验中所用的溶液,配制用的蒸馏水都需事先煮沸,原因是 。
(3)实验开始生成H2气后, 为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应 阀门A、 阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是 , 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质6.34 g,实验后得干燥纯净的[Cr(CH3COO)2]2·2H2O 5.64 g,请计算该实验所得产品的产率 。
(6)若使用该装置制备Fe(OH)2,且能较长时间看到Fe(OH)2白色沉淀现象。则在1、2、3中应装入的试剂依次为 、 、 。(写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对废银合金触电材料进行分离回收既节约矿物资源,又可以减少环境污染。某废银合金触电材料含Ag、Cu、Sn等,现欲利用以下工艺流程回收其中的金属资源。
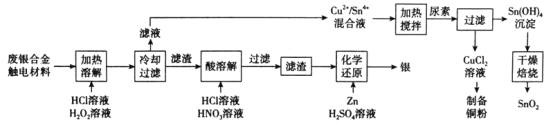
回答下列问题:
(1)“加热溶解”时Cu发生的离子方程式为_________。
(2)“加热溶解”时温度常控制在50℃左右,温度不宜过高也不宜过低的原因为_________。
(3)“酸溶解”过程中会产生少量遇空气变为红棕色的无色气体,则“酸溶解”过程主要的化学方程式为_____________。
(4)常温下,Cu2+/Sn4+混合液中c(Cu3+)=0.022mol·L-1,将混合液“加热搅拌”后冷却至室温,再加“尿素”调节溶液的pH范围为__________。(当溶液中的离子浓度小于10-5mol·L-1时,沉淀完全,已知:Ksp[Sn(OH)4]=1×10-55;Ksp[Cu(OH)2]=2.2×10-20)
(5)检验Sn(OH)4沉淀是否洗涤干净的方法是____________。
(6)用惰性电极电解CuCl2溶液,阴极反应式是___________,若想由CuCl2溶液得到无水CuCl2固体,则需进行的实验操作为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验仪器的说法不正确的是( )
A.用电子天平称量固体,读数时侧门应关闭
B.用托盘天平称取![]() 固体时,将
固体时,将![]() 的砝码放在右盘,将游码移到
的砝码放在右盘,将游码移到![]() 的位置
的位置
C.紫外可见分光光度计可用于测定待测物对紫外光、可见光的吸光度,并进行定性和定量分析
D.核磁共振仪能确定有机分子中的氢原子种类和个数比,有助于分析有机物的结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com