
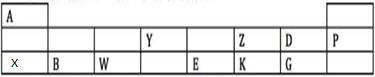
 ,故答案为:F;
,故答案为:F; ;
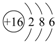
;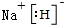 ;NaH中H元素显-1价,所以据此H元素在元素周期表中也可以排在VIIA族,
;NaH中H元素显-1价,所以据此H元素在元素周期表中也可以排在VIIA族,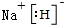 ;VII.
;VII.


科目:高中化学 来源: 题型:
| A、Ag+、Fe3+、Cl-、SO42- |
| B、Mg2+、Al3+、Cl-、SO42- |
| C、NH4+、OH-、Cl-、H+ |
| D、Ba2+、H+、SiO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
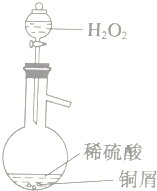
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
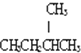 ;D:
;D: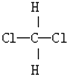 和
和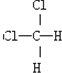

查看答案和解析>>
科目:高中化学 来源: 题型:
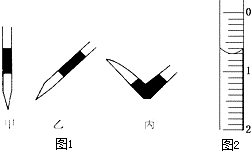 使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.
使用酸碱中和滴定法测定某未知物质的量浓度的稀盐酸.滴定次数 实验数据/mL | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.80 | 15.00 | 15.02 | 14.98 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
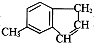 )是一种医药合成中间体,某同学设计它的合成路线如下:
)是一种医药合成中间体,某同学设计它的合成路线如下: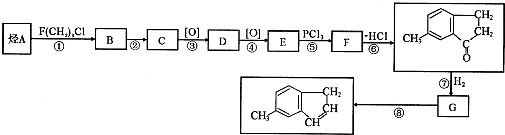
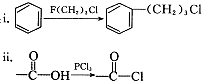
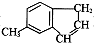 )的说法正确的是
)的说法正确的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②② | D、② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| pH | c(CrO42-) | c(HCrO4-) | c(Cr2O72-) | c(H2CrO4) |
| 4 | 0.0003 | 0.1030 | 0.4480 | 0 |
| 6 | 0.0319 | 0.0899 | 0.4370 | 0 |
| 7 | 0.2645 | 0.0860 | 0.3195 | 0 |
| 9 | 0.8960 | 0.0031 | 0.0004 | 0 |
| A、铬酸的第一步电离方程式为:H2CrO4=H++HCrO4- |
| B、该铬酸溶液的物质的量浓度约为1.00mol/L |
| C、pH越大,HCrO4-越容易电离出CrO42- |
| D、NaHCrO4溶液中:c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com