
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源:不详 题型:单选题
 SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为
SO3(g) △H = ―98.32kJ/mol,在容器中充入2molSO2 和1molO2充分反应,最终放出的热量为| A.196.64kJ | B.196.64kJ/mol |
| C.<196.64kJ | D.>196.64kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=H2O(l) ΔH4;
O2(g)=H2O(l) ΔH4;| A.1个 | B.2个 | C.3个 | D.4个 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
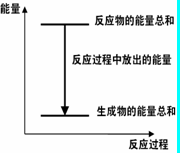
| A.反应过程中能量关系可用右图表示 |
| B.若将该反应设计成原电池锌为负极 |
| C.ΔH的值与反应方程式的计量系数无关 |
| D.若将其设计为原电池当有32.5g锌溶解时, |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g)=2H2O(l) ΔH=-142.9kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1 |
| C.2H2+O2=2H2OΔH=-571.6kJ·mol-1 |
| D.H2(g)+1/2O2(g)=H2O(g)ΔH=-285.8kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.锌和稀盐酸反应制取氢气 |
| B.灼热的碳与二氧化碳反应 |
| C.碳酸钙的分解 |
| D.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
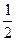 O2(g) = H2O(l) △H = -285.8 kJ / mol
O2(g) = H2O(l) △H = -285.8 kJ / mol查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-824.39 kJ·mol-1 | B.+ 627.6 kJ·mol-1 |
| C.-744.7 kJ·mol-1 | D.-169.4 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com