
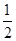 N2(g)+
N2(g)+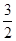 H2(g)
H2(g) NH3(g)的
NH3(g)的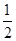 ×946kJ·mol-1+
×946kJ·mol-1+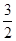 ×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.按键型分类,该晶体中含有非极性共价键 |
| B.含N5+离子的化合物中既有离子键又有共价键 |
| C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体 |
| D.这种固体的可能潜在应用是烈性炸药或高能材料 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃料的燃烧反应都是放热反应 |
| B.绿色植物进行光合作用时,能把光能转化为化学能 |
| C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 |
| D.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则说明相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放热92.4kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )
CuSO4(s)+5H2O(1),热效应为ΔH3。则下列判断正确的是( )| A.ΔH2>ΔH3 | B.ΔH1<ΔH3 | C.ΔH1+ΔH3=ΔH2 | D.ΔH1+ΔH2=ΔH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol
1/4CaS(s)+CO2(g) △H1=-47.3kJ/mol CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol
CaO(s)+ CO2(g)+ SO2(g) △H2=+210.5kJ/mol 1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol
1/2C(s)+1/2CO2(g) △H3=-86.2kJ/mol CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
CaS(s)+CaO(s)+C(s)+6CO2(g)+SO2(g)的△H= (用△H1△H2△H3表示)。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

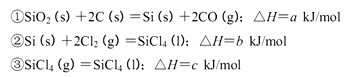
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com