
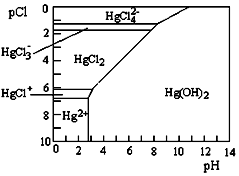
 Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )| A. | 配制Hg(NO3)2溶液时,为了防止Hg2+水解,应将Hg(NO3)2固体溶于浓硝酸后再稀释 | |
| B. | 当c(Cl-)=0.1 mol•L-1,pH<8时,汞元素主要以HgCl3-形式存在 | |
| C. | HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3- | |
| D. | 当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2 |
分析 A.硝酸汞水解显酸性,抑制水解加入酸;
B.当c(C1-)=10-1 mol/L时,根据图象分析;
C.HgCl2是一种弱电解质,根据溶液中离子存在方式判断电解质电离方式;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,根据图片中微粒存在方式判断;
解答 解:A.硝酸汞水解显酸性,配制Hg(NO3)2溶液时,为了防止Hg2+水解,应将Hg(NO3)2固体溶于浓硝酸后再稀释,故A正确;
B.当c(C1-)=10-1 mol/L时,汞元素主要是以HgCl42-形式存在,故B错误;
C.HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3ˉ,故C正确;
D.根据图象可知当溶液pH保持在5,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2,故D正确;
故选B.
点评 本题考查了溶解平衡的有关应用与判断等知识点,正确分析图象中曲线变化是解本题关键,再结合外界条件对平衡的影响等知识点来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH3分子中所有原子在一个平面上 | |
| B. | 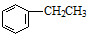 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 的同分异构体中,苯环上的一氯代物只有一种的结构有4种 | |
| C. | CH2=CHCH2OH能发生加成发应、取代反应、氧化反应等 | |
| D. | 苯乙烯(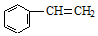 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 )能使溴水褪色,1mol苯乙烯与溴水反应时最多消耗4mol Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| B. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 氧化镁熔点高,可用于耐高温材料 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物 | |
| B. | Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同 | |
| C. | 乙醇分子中含羟基,可与金属钠反应生成氢气 | |
| D. | MnO2具有较强氧化性,可作为H2 O2分解反应的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向海水中加入净水剂明矾可以使海水淡化 | |
| B. | 开发利用可燃冰(固态甲烷水合物),有助于海洋生态环境的治理 | |
| C. | 海水淡化的方法主要有电渗析法、蒸馏法、离子交换法等 | |
| D. | 海洋植物具有富集碘的能力,因此从海产品中提取碘是工业上获取碘的重要途径,工业从海带中提取碘经历的步骤有:浸泡-过滤-氧化-萃取-粗碘提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
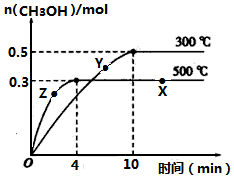 一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.
一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)?CH3OH(g)达到化学平衡状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
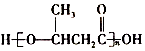 )的流程如图:
)的流程如图: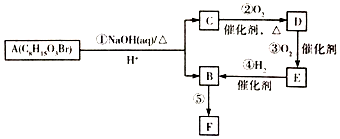
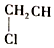 =
=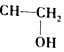
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ZnCl2 | B. | NaCl | C. | AlCl3 | D. | KCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com