
| A. | O | B. | S | C. | P | D. | C |
科目:高中化学 来源: 题型:实验题
 某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
某课外活动小组探索苯与液溴的反应是否属于取代反应,设计了如下实验装置.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
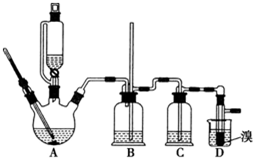 实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH
实验室制备 1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{1700℃}^{H_{2}SO_{4}(浓)}$CH2=CH| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制乙烯时,用排水法或向上排空气法收集气体 | |
| B. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| C. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| D. | 制二氧化氮时,用水或NaOH溶液吸收尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
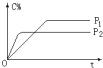 可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )
可逆反应A(气)+2B(气)?nC(气),在不同压强(P1、P2)下,测得C的体积分数跟反应时间的关系如图所示,以下结论正确的是( )| A. | P1>P2,n>3 | B. | P1>P2,n<3 | C. | P1<P2,n<3 | D. | P1<P2,n>3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com