
下列有关实验操作或仪器的使用正确的是( )

科目:高中化学 来源: 题型:
将1L 0.1 mol·L-1 BaCl2溶液与足量稀硫酸充分反应放出a kJ热量;将1L 0.5 mol·L-1 HCl溶液与足量CH3COONa溶液充分反应放出b kJ热量(不考虑醋酸钠水解);将0.5L 1 mol·L-1 H2SO4溶液与足量(CH3COO)2Ba(可溶性强电解质)溶液反应放出的热量为( )
A.(5a+2b) kJ B.(4b-10a) kJ C.(5a-2b) kJ D.(10a+4b) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)实验室配制好的硅酸钠溶液保存过程中变质的主要原因是________________________________________________________________________,
变质现象是________,相应化学方程式是______________________________。
(2)盛放烧碱等碱性溶液不宜用磨口玻璃塞。因为__________________________ ____________________________________________________________________________,
写出相应的离子方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
烧瓶中放入铜片和稀硝酸,来制取较纯净的一氧化氮,反应开始后发现烧瓶中出现红棕色气体,这时的操作应是( )
A.立即接上收集容器,用向上排空气法收集
B.待烧瓶中红棕色气体消失后,用向上排空气法收集
C.待烧瓶中红棕色气体消失后,用排水法收集
D.立即用排水法收集
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸在反应中的价态变化:向铜片中加入浓硝酸,回答下列问题:
(1)开始阶段实验现象为:____________________ ______________。
反应的化学方程式为:__________________________________。
(2)若铜有剩余,则临近结束时的反应方程式为:________________________________________________________________________。
(3)当反应结束后,若通过分液漏斗向烧瓶内再加入稀盐酸,又可继续反应,产生无色无味的气体,此时的离子方程式可表示为:________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法不正确的是( )
A.分液时,分液漏斗中的上层液体应由上口倒出
B.用加热分解的方法区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH 时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于氯化铁溶液和氢氧化铁胶体的说法中,正确的是( )
|
| A. | 两种分散系均呈红褐色 | B. | 分散质粒子均能透过半透膜 |
|
| C. | 分散质粒子直径均在1﹣100nm之间 | D. | 可用丁达尔效应加以鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在相应的条件下能大量共存的是( )
|
| A. | 在c(H+)/c(OH﹣)=1×10﹣14的溶液中:NH4+、Ca2+、Cl﹣、K+ |
|
| B. | 水电离的c(H+)=10﹣13mol•L﹣1的溶液中:Fe3+、SO42﹣、K+、SCN﹣ |
|
| C. | 在c(H+)=10﹣14mol/L的溶液中可能含:Na+,AlO22﹣,CO32﹣,SO32﹣ |
|
| D. | c(OH﹣)=1×10﹣14mol/L的溶液中:Na+、K+、Cl﹣、S2O32﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
由此可得出
A.对应等物质的量浓度钠盐溶液pH关系为: pH(Na2CO3) > pH(NaCN) > pH(CH3COONa)
B.CO2通入NaCN溶液中有:CO2+H2O+2NaCN→Na2CO3+2HCN
C.冰醋酸中逐滴加水,溶液的导电性、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)=c(OH-)+c(HCO ) +c(CO
) +c(CO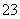 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com