
| A. | 钠浮在水面上--熔点低 | B. | 水蒸气--生成气体 | ||
| C. | 咝咝发出响声--反应剧烈 | D. | 游动--密度小于水 |
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:填空题
原子序数依次增加的X、Y、Z、W四种元素原子序数均小于36, Y基态原子最外层电子数是其内层电子总数的3倍,X、W基态原子是同周期元素中未成对电子数最多的原子,X与Z的原子核内质子数之和等于W原子核内质子数,Z基态原子只有1个未成对的电子。
回答下列问题:
(1)已知化合物XZ3与H2Y(Y的氢化物)发生反应的化学方程式为XZ3+H2Y→XH3+HZY,则元素的电负性:Y Z(填“大于”或“小于”),化合物HZY分子的空间构型为 。
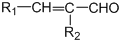
(2)X的一种氢化物的相对分子质量为32,1mol该氢化物中的σ键数是 ,该氢化物在水中的溶解性如何?主要原因是什么?
(3)元素Y 3个原子形成的单质分子与元素X、Y形成的一种离子互为等电子体,这种离子的化学式是 。
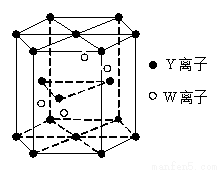
(4)基态W原子的电子排布式是 ,元素Y和W的一种化合物的晶体结构如右图所示,该晶体的化学式为 。(W处于晶体内部,Y分别处于晶胞面心、顶点、和内部)
(5)金属原子 (选填“钾”、“镁”、“铜”)形成的晶体的堆积方式,与上述晶胞中Y离子的堆积方式相同。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (R为烃基).其中一种辣椒素酯类化合物J的合成路线如下:
(R为烃基).其中一种辣椒素酯类化合物J的合成路线如下: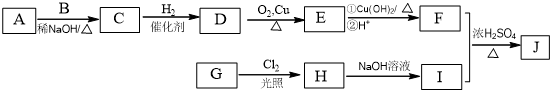
 +H2O
+H2O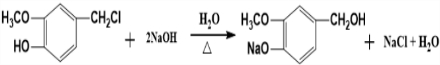 .
. .
.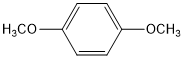 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
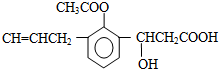
| A. | M中至少有8个碳原子共面 | |
| B. | M能发生还原、氧化、中和、缩聚、取代、加成、银镜等反应 | |
| C. | M中苯环上的一氯取代物有两种不同的结构 | |
| D. | 1molM消耗Na、NaOH、NaHCO3的物质的量的比是2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋的主要成分是乙酸,可同时用作防腐剂和调味剂 | |
| B. | 亚硝酸钠可能致癌,人们应尽量少吃腌制食物 | |
| C. | 我国应禁止使用味精,避免它对人体健康的损害 | |
| D. | 营养强化剂是补充食品中缺乏的营养成分或微量元素 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.CaH2的电子式:[H:]‑Ca2+[:H]-
B.Cl-的结构示意图:
C.质子数为92、中子数为146的U原子: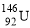
D.2,4,6-三硝基苯甲酸结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
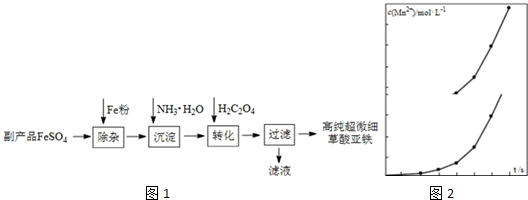
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com