
| A. | H(g)+Cl(g)═HCl(g)△H=-431kJ•mol-1 | |
| B. | 2HCl(g)═H2(g)+Cl2(g)的反应热△H<0 | |
| C. | H2(g)+Cl2(g)═2HCl(g)△H=-183kJ | |
| D. | 相同条件下,H2(g)+Cl2(g)═2HCl(g)反应在光照和点燃条件下的△H不相等 |
分析 A.根据断裂要吸收热量,形成则要放出热量;
B.根据正逆反应焓变符合相反判断;
C.热化学方程式反应热的单位为kJ/mol;
D.焓变与反应条件无关.
解答 解:A.因为断裂H-Cl要吸收431kJ,所以H(g)+Cl(g)=HCl(g)△H=-431 kJ•mol-1,故A正确;
B.H2(g)+Cl2(g)=2HCl(g),反应热△H=生成物的键能-反应物的键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,即△H=-183kJ/mol,所以2HCl(g)=H2(g)+Cl2(g)的反应热△H>0,故B错误;
C.H2(g)+Cl2(g)=2HCl(g)的反应热=反应物的总键能减生成物的总键能=436kJ•mol-1+243kJ•mol-1-2×431 kJ•mol-1=-183kJ•mol-1,热化学方程式H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol,故C错误;
D.因为焓变与反应条件无关,所以H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相等,故D错误;
故选A.
点评 本题主要考查了反应热的计算,难度不大,注意掌握热化学方程式的书写,明确反应热等于反应物的总键能-生成物的总键是关键.


科目:高中化学 来源: 题型:解答题
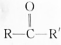 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若开始时通入3molA和3molB,则达到平衡时,生成C的物质的量为3amol | |
| B. | 若开始时通入4molA和4molB、2molC,则达到平衡时,生成B的物质的量一定大于4mol | |
| C. | 若开始时通入2molA和2molB、1molC,则达到平衡时,在通入3molC,则再次达到平衡后,C的体积分数为$\frac{a}{2-a}$ | |
| D. | 若在原平衡体系中,在通入1molA和1molB,则混合气体的平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 步骤1中减少的固体一定是混合物 | |
| B. | 根据上述步骤可以判断矿物X中$\frac{n(F{e}_{2}{O}_{3})}{n(C{u}_{2}O)}$<1 | |
| C. | 根据步骤2可以得出蓝色溶液中n(Cu2+)=0.02mol | |
| D. | 根据步骤1、2可以判断出X中氧化铁的质量分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2S+SO2═3S↓+2H2O | B. | Zn+CuSO4═Cu+ZnSO4 | ||
| C. | KClO3+6HCl═KCl+3Cl2↑+H2O | D. | 2FeCl2+Cl2═2FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com