
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
科目:高中化学 来源:不详 题型:填空题
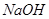 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的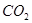 。
。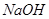 溶液吸收
溶液吸收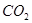 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L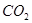 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。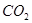 和
和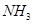 为原料可合成化肥尿素[
为原料可合成化肥尿素[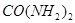 ]。已知:
]。已知:
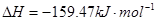 ①
①
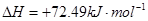 ②
②
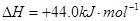 ③
③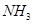 和
和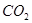 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。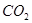 通过反应可转化为
通过反应可转化为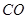 ,在催化剂作用下CO和
,在催化剂作用下CO和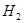 反应生成甲醇:
反应生成甲醇: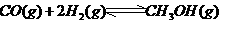 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。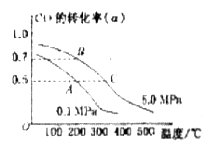
 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)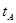 _______
_______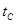 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
CH3OH(g);CO的平衡转化率(α)与温度、压强的关系如图所示。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 cC(气)+dD(气);ΔH=Q,根据图回答:
cC(气)+dD(气);ΔH=Q,根据图回答:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 CO2(g)+H2(g) △H=-41.2kJ·mol-1
CO2(g)+H2(g) △H=-41.2kJ·mol-1 CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。
CH3CH2OH(g)+H2O(g) △H= -256.1kJ·mol-1。 CH3CH2OH(g)+3H2O(l) △H= 。
CH3CH2OH(g)+3H2O(l) △H= 。
| A.该流程至少包含4种形式的能量转化 |
| B.装置X中阴极反应为:2H2O-4e-=4H++O2↑ |
| C.合成塔中生成乙醇的反应是化合反应 |
| D.流程设计体现了绿色化学思想 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题


 4CO(g)+BaS(s) △H1 = +571.2kJ/mol ①
4CO(g)+BaS(s) △H1 = +571.2kJ/mol ① 2CO(g) △H2 = +172.5kJ/mol ②
2CO(g) △H2 = +172.5kJ/mol ② 2CO2(g) + BaS(s) △H3 =
2CO2(g) + BaS(s) △H3 = 查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2912 kJ | B.2953 kJ | C.3236 kJ | D.3867 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、
、 、CO等大气污染气体的测量及处理具有重要意义。
、CO等大气污染气体的测量及处理具有重要意义。 可使
可使 等氧化,常用于定量测定CO的含量。已知:
等氧化,常用于定量测定CO的含量。已知:
 反应生成
反应生成 的热化学方程式:________________。
的热化学方程式:________________。 恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。
恰好完全反应生成正盐,则此时溶液呈________性(填“酸”或“碱”)。

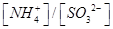 ________2(填“>”“<”或“=”)
________2(填“>”“<”或“=”) 可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将
可用强碱溶液吸产生硝酸盐。在酸性条件下,FeSO4溶液能将 还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。
还原为NO,写出该过程中产生NO反应的离子方程式___________________________________。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com