
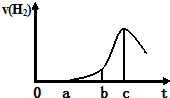
 某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500mL 0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.分析 (1)5.4gAl的物质的量为0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸的物质的量为0.25mol,Al过量,硫酸反应完全,由图可知,开始不生成氢气,为氧化铝与硫酸的反应,然后Al与硫酸反应生成氢气,开始温度较低,由于反应放热,则温度升高反应速率加快,之后氢离子浓度减小,则反应速率减小;
(2)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,只能是氯离子起了催化作用;
(3)影响该化学反应速率的因素只可能是温度、浓度、接触面积和催化剂,据此分析.
解答 解:(1)5.4gAl的物质的量为:0.2mol,500mL 0.5mol•L-1的硫酸溶液中含硫酸的物质的量为:0.5mol/L×0.5L=0.25mol,Al过量,硫酸反应完全,
①曲线a→b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率,故①正确;
②曲线由b→c段,产生氢气的速率增加较快的主要原因为该反应为放热反应,温度升高,反应速率加快,故②正确;
③曲线由c以后,产生氢气的速率逐渐下降的主要原因为氢离子浓度减小,反应速率减小,故③错误;
故答案为:③;
(2)其他条件不变,现换用500mL 1mol•L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol•L-1硫酸的快,只能是氯离子起了催化作用或SO42-有阻化作用(使反应变慢),
故答案为:②④;
(3)①加入某种催化剂,加快反应速率; ②加入蒸馏水,稀释溶液,反应速率减慢;③将铝片换成铝粉,增大反应物的接触面积,反应速率增大;④增加硫酸的浓度至18mol/L,发生钝化;其他加快铝与硫酸溶液制H2的反应速率有升高温度;加入少量CuSO4溶液,形成原电池等;
故答案为:升高温度,加入少量CuSO4溶液;②④.
点评 本题考查了化学反应速率的影响因素,为高频考点,题目难度中等,侧重于学生的分析能力的考查,注意根据图象分析理解随反应进行影响反应速率的主要因素,试题培养了学生的分析能力及化学实验能力.


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:选择题
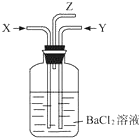 碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )| A. | 在Z导管口有红棕色气体出现 | |
| B. | 洗气瓶中产生的沉淀是BaCO3和BaSO3的混合物 | |
| C. | 洗气瓶中产生的沉淀是BaSO3 | |
| D. | 在Z导管出来的气体中无CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 沸点:H2O>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含共价键,共价化合物中可能含离子键 | |
| B. | 碘易升华是因为分子间的共价键较弱 | |
| C. | 构成单质分子的微粒一定含有化学键 | |
| D. | 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Penguinone分子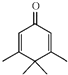 所有碳原子不可能都在同一个平面上 所有碳原子不可能都在同一个平面上 | |
| B. | 1mol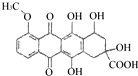 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol 分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为5 mol、3 mol、1 mol | |
| C. | 醋酸和软脂酸互为同系物,C5H12和C9H20也一定互为同系物 | |
| D. | 蛋白质遇到醋酸铅生成沉淀,加入大量的水,沉淀还可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B两种元素可组成化学式为BA4的化合物 | |
| B. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| C. | 原子半径由大到小的顺序是C>B | |
| D. | 气态氢化物的稳定性由强到弱的顺序是C>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L盐酸 | B. | 0.01mol/L盐酸 | C. | 0.1mol/L醋酸 | D. | 0.01mol/L醋酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com