
分别进行下列操作,由现象得出的结论正确的是( )
选项 | 操作 | 现象 | 结论 |
A | 滴加Ba(NO3)2和HNO3混合溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 将乙烯通入溴水中 | 溴水褪色 | 乙烯与溴水发 |
C | 分别将少量钠投入到盛有水和乙醇的烧杯中 | 盛水烧杯中反应剧烈 | 水中的氢比乙醇中的氢活泼性强 |
D | 滴加NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH |
科目:高中化学 来源:2016-2017学年广西柳州铁路一中高二上段考理化学卷(解析版) 题型:选择题
在一定条件下,使NO和O2在一密闭容器中进行反应,下列说法中不正确的是( )
A.反应开始时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后为零
C.随着反应的进行,逆反应速率逐渐增大,最后不变
D.随着反应的进行,正反应速率逐渐减小,最后不变
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省、醴陵四中高二上期中化学卷(解析版) 题型:选择题
下列电离方程式不正确的是( )
A.醋酸溶于水:CH3COOH=CH3COO﹣+H+
B.Na2SO4溶于水:Na2SO4=2Na++SO42﹣
C.碳酸氢钠溶于水:NaHCO3=HCO3﹣+Na+
D.次氯酸溶于水:HClO H++ClO﹣
H++ClO﹣
查看答案和解析>>
科目:高中化学 来源:2017届云南师大附中高三上月考三化学试卷(解析版) 题型:选择题
某有机物的结构简式如图3所示,下列有关该物质的叙述,正确的是
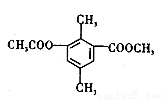
A.分子中不同化学环境的氢共有4种
B.分子中所有的碳原子不可能共平面
C.lmol该有机物与足量NaOH溶液反应,最多消耗3mol NaOH
D.能发生取代、消去、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源:2017届四川省高三上综合测试三化学卷(解析版) 题型:实验题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,容易分解,工业上制备高铁酸钾的基本流程如下图所示:

(1)K2FeO4中铁化合价为 在农业生产中,滤液1可用作。
(2)氧化过程中搅拌目的是 由粗品到纯品的实验方法是
(3)上述Fe(OH)3浆料中加入KClO溶液进行氧化过程中,发生反应的离子方程式是:,控制反应温度30℃ 以下的原因是: 。
(4)结晶过程中加入浓KOH溶液的作用是: 。
(5)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KClO3的混合液,经测定ClO-与C lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
lO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上模拟三化学试卷(解析版) 题型:填空题
(化学---选修3:物质结构和性质)锂—磷酸氧铜电池正极的的活性物质是Cu4O(PO4)2,可通过下列反应制备:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:____________,与Cu同周期的元素中,与铜原子最外层电子数相等的元素还有___________(填元素符号),上述方程式中涉及到的N、O元素第一电离能由小到大的顺序为________________。
(2)PO43-的空间构型是___________。
(3)与NH3具有相同空间构型和键合形成的分子或离子有_________、___________(各举一例)
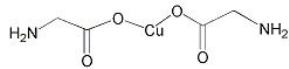
(4)氨基乙酸铜的分子结构如图,氮原子的杂化方式为______________。
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1molCN-中含有的π键的数目为___________。
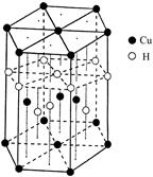
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图所示。则该化合物的化学式
为______________________。
(7)铜晶体为面心立方最密堆积,铜的原子半径为127.8pm,列出晶体铜的密度表达式____________。
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上模拟三化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.向20mL0.5mol/LFeBr2(ap)中通入224mLCl2(标准状况):2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.25℃时,向2mL0.1mol﹒L-1Na2S溶液中滴入几滴0.1mol﹒L-1ZnSO4溶液,有白色沉淀生成;再滴加几滴0.1mol﹒L-1CuSO4溶液,则又有黑色沉淀生成,可以得出结论:Ksp(ZnS)>Ksp(CuS)
C.向30mL0.5mol/LNaOH(aq)中通入224mLCO2(标准状况):3OH-+2CO2=CO32-+HCO3-+H2O
D.已知25℃时,CH3COOH的Ka=1.8×10-5,HClO的Ka=3.0×10-8,等浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度的大小关系是:C(Na+)> C(ClO-)> C(CH3COO-)> C(OH-)> C(H+)
查看答案和解析>>
科目:高中化学 来源:2017届陕西省高三上期中化学试卷(解析版) 题型:选择题
X、Y、Z、W为原子序数依次增大的短周期元素.其形成的小分子化合物Y2X2、Z2X4、X2W2中,分子内各原子最外层电子都满足稳定结构.下列说法正确的是( )
A. X、Y、Z、W的原子半径的大小关系为:W>Y>Z>X
B. 在Y2X2、Z2X4、X2W2的一个分子中,所含的共用电子对数相等
C. X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的化合物
D. 与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二上学期期中化学试卷(解析版) 题型:填空题
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40mg/kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法[来源:学 | 烹调时,待食品熟后加入碘盐 |
要在食盐中加碘,是因为碘是人体内合成____________________激素的主要原料,缺碘会引起疾病。在人体中,碘是属于 (选填“常量”或“微量”)元素。
食盐中加碘,这碘指的是______________(填“元素”、“原子”或“单质”)。
碘酸钾的化学式为KIO3,其中碘元素的化合价为_________________。
根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时是_______________(“容易”或“不容易”)分解。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com