
【题目】已知元素X位于Y的下一周期,X、Y的原子序数均不大于20.某含氧酸盐甲的化学式 为XYO3。请回答:
(1)常温下X的单质能与水发生反应,395℃时,甲能发生分解反应生成两种盐,一种是 含Y元素的无氧酸盐,则X位于周期表_____,甲发生分解反应的化学方程式是_____。
(2) 若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体.
①则甲为_____(填化学式)该气体能使酸性高锰酸钾溶液褪色, 该反应的离子方程式为_____;
②X、Y形成简单离子半径大小关系为 > (用离子符号表示)._________
③25℃时,甲在水中的沉淀溶解平衡曲线如右图所示,若要使溶液 X2+离子沉淀完全,则 YO32-离子的最小浓度为_____mol·L-1。
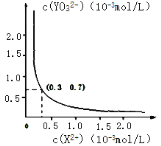
(当离子浓度小于 1×10-5mol·L-1 时,该离子沉淀完全)
(3)若甲能与盐酸反应,生成无色、无味的气体乙.则:
①乙的电子式为_____;
②甲在水中持续加热生成一种更难溶的物质并逸出气体乙,该反应的化学方程式为___。
【答案】第 4 周期 第ⅠA 族4KClO3![]() 3KClO4+KClCaSO35SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-S2->Ca2+0.021
3KClO4+KClCaSO35SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-S2->Ca2+0.021![]() MgCO3 + H2O =Mg(OH)2 + CO2↑
MgCO3 + H2O =Mg(OH)2 + CO2↑
【解析】
(1)含氧酸盐甲的化学式为XYO3,则X为金属,Y为非金属,X、Y的原子序数均不大于20,X的单质能与水发生反应,故元素X为K,X位于Y的下一周期,则元素Y为Cl,元素X为K,K核外电子数为19,有4个电子层,最外层有1个电子,位于周期表中第四周期第ⅠA族;X、Y形成简单离子,其核外电子排布相同,则核大径小,X核电荷数19,Y核电荷数17,故X小于Y;则含氧酸盐甲的化学式为KClO3,KClO3能发生分解反应生成两种盐,一种是含Cl元素的无氧酸盐,由电子、原子守恒可以知道该反应的化学方程式是:4KClO3![]() 3KClO4+KCl ;综上所述,本题答案是:第4周期 第ⅠA 族; 4KClO3
3KClO4+KCl ;综上所述,本题答案是:第4周期 第ⅠA 族; 4KClO3![]() 3KClO4+KCl 。
3KClO4+KCl 。
(2)若甲难溶于水,且甲与盐酸反应生成能使品红溶液褪色的气体,则该气体为SO2,此反应为复分解反应,则反应前后元素价态不变,则甲中含S元素且为+4价,根据化合价代数和为0,则XSO3中元素X为+2价,且甲难溶于水,则元素X为Ca,甲为CaSO3,
①由以上分析得,甲为CaSO3,SO2和高锰酸钾发生氧化还原反应,对应的离子方程式为:5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-;综上所述,本题答案是:CaSO3 ; 5SO2+2MnO4-+2H2O=4H++2Mn2++5SO42-。
②据以上分析可知XYO3为CaSO3,X为Ca,Y为S,形成简单离子,其核外电子排布相同,则核大径小,因此离子半径是S2->Ca2+;因此本题答案是:S2->Ca2+。
③25℃时,由甲在水中的沉淀溶解平衡曲线图可以知道Ksp=0.3×10-3×0.7×10-3=2.1×10-7;若要使溶液X2+离子沉淀完全,则加入YO32-离子的最小浓度为2.1×10-7/1×10-5=2.1×10-2 mol·L-1;因此,本题正确答案是: 0.021。
(3)甲能与盐酸反应,生成无色、无味的气体乙,且甲在水中持续加热生成一种更难溶的物质并逸出气体乙,则甲为MgCO3,乙为CO2,
① CO2 为共价化合物, CO2分子中碳氧原子间形成2对共用电子对,其电子式为:![]() ;因此本题答案是:
;因此本题答案是:![]() 。
。
②甲在水中持续加热生成一种更难溶的物质并逸出CO2气体,该反应的化学方程式为:MgCO3 + H2O =Mg(OH)2 + CO2↑;因此本题答案是:MgCO3 + H2O =Mg(OH)2 + CO2↑。


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】CO2的转换在生产、生活中具有重要的应用。
Ⅰ.CO2的低碳转型对抵御气候变化具有重要意义。
(1)海洋是地球上碳元素的最大“吸收池”。
①溶于海水中的CO2主要以四种无机碳形式存在,除CO2、H2CO3两种分子外,还有两种离子的化学式为____________。
②在海洋碳循环中,可通过下图所示的途径固碳。写出钙化作用的离子方程式:_____________。

(2)将CO2与金属钠组合设计成Na-CO2电池,很容易实现可逆的充、放电反应,该电池反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
2Na2CO3+C。放电时,在正极得电子的物质为______;充电时,阳极的反应式为_____。
Ⅱ.环境中的有害物质常通过转化为CO2来降低污染。
(3)TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物转化为CO2等小分子物质。下图为在TiO2的催化下,O3降解CH3CHO的示意图,则该反应的化学方程式为____。

(4)用新型钛基纳米PbO2作电极可将苯、酚类等降解为CO2 和H2O。该电极可通过下面过程制备:将钛基板用丙酮浸泡后再用水冲洗,在钛板上镀上一层铝膜。用它做阳极在草酸溶液中电解,一段时间后,铝被氧化为氧化铝并同时形成孔洞。再用Pb(NO3)2溶液处理得纳米PbO2,除去多余的氧化铝,获得钛基纳米PbO2电极。
①用丙酮浸泡的目的是______。
②电解时,电流强度和基板孔洞深度随时间变化如图所示,氧化的终点电流突然增加的原因是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中加入4molSO2和2molO2,发生下列反应2SO2(g)+O2(g)![]() 2SO3(g),
2SO3(g),
(1)若充分反应后能否得到4molSO3?为什么?__________________________
(2)若经5s后,剩下的SO2为2.5mol,则用O2表示的反应速率是多少?5s末SO3浓度是多少?
______________、__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向未知水溶液中加入AgNO3溶液有白色沉淀生成,再加入稀硝酸后,沉淀部分溶解,且有无色无味的气体生成,将此气体通入澄清石灰水石灰水变浑浊,由此判断未知水溶液中可能含有
A. CO32-、 NO3- B. Cl-、NO3- C. Cl-、CO32- D. Cl-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、L、I九种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中B、C、D为同一周期,A与E、B与G、D与L分别为同一主族,C、D、F三种元素的原子序数之和为28,F的质子数比D多5,D的最外层电子数是F最外层电子数的2倍。C和D的最外层电子数之和为11。请回答下列问题:
(1)以上非金属元素中所形成的最简单气态氢化物稳定性最弱的是(填化学式)______,E、F、L所形成的简单离子的半径由小到大的顺序为(用离子符号表示)_____。
(2)由L、I两元素可按原子个数比1∶1组成化合物X,化合物X中各原子均满足8电子的稳定结构,则X的电子式为____。
(3)少量固体化合物E2D2投入到化合物E2L的水溶液中,只观察到有淡黄色沉淀产生,并无气泡冒出,请结合信息写出该反应的离子方程式 _____________________________。
(4)由A、B、C、D按原子个数比4∶1∶1∶2形成一种化合物Y,则Y的化学式为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分类正确的是
A. 氯水、氨水均为电解质 B. Na2O2为碱性氧化物
C. NaOH、NH3·H2O都为可溶性碱 D. 蛋白质溶液、液氯均属于分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸是实验室常用的一类物质,下列关于酸的认识和判断正确的是
A. HCl、CH3COOH均为含氧酸 B. 稀H2SO4具有强氧化性
C. 酸洒到实验台上,应用NaOH溶液处理 D. 铁、铝遇到冷的浓硫酸会发生钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是极其重要的化工原料,工业上将产生的NO2在密闭容器中用水多次反复循环吸收制备硝酸。
(1)工业上用水吸收NO2生产HNO3,生成的气体经多次氧化、吸收的循环操作充分转化为硝酸(假定上述过程无其他损失)。试写出上述反应的化学方程式:_______
(2)为了证明NO也可以与氧气和水共同反应生成HNO3,某学生设计了如图所示装置(有关夹持装置已略去)。

①检查装置气密性良好后,为观察到NO气体生成,打开K1,关闭K2,应从U形管的长管口注入稀硝酸至____后,迅速关闭K1,观察到U形管内的现象是______。
②装置Ⅲ中发生反应的化学方程式为__________。
③蘸NaOH溶液的棉花团的作用是____________。
④打开K2,至装置Ⅱ中长玻璃管中的气体呈无色后,打开K3,反应一段时间后,长玻璃管中并未充满液体。设计简单方法检验长玻璃管中的气体是否含NO______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化石燃料开采、加工过程产生的H2S 废气制取氢气,既价廉又环保。
(1)工业上可用组成为K2O·M2O3·2RO2·nH2O的无机材料纯化制取的氢气。
①已知元素M、R均位于元素周期表中第3周期,两种元素原子的质子数之和为27,则R的原子结构示意图为____________;
②常温下,不能与M单质发生反应的是____________(填序号);
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
(2)利用H2S废气制取氢气的方法有多种。
①高温热分解法已知:H2S(g)![]() H2(g)+1/2S2(g)
H2(g)+1/2S2(g)
在恒容密闭容器中,控制不同温度进行H2S分解实验。以H2S起始浓度均为c mol·L-1测定H2S的转化率,结果见图。曲线a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。根据图像回答下列问题:

i 计算 985 ℃时H2S按上述反应分解的平衡常数 K=________;
ii 说明随温度的升高,曲线b向曲线a逼近的原因:________________________________;
②电化学法

i该法制氢过程如图。反应池中反应物的流向采用气、液逆流方式,其目的是____________;
ii反应池中发生反应的化学方程式为____________;
iii反应后的溶液进入电解池,电解总反应的离子方程式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com