
1L某混合溶液中可能含有的离子如下表:
可能大量含有的阳离子 H+NH4+Al3+K+
可能大量含有的阴离子 Cl﹣Br﹣I‑ClO‑AlO2﹣
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生 沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如图所示.
①则该溶液中确定含有的离子有 ;
②不能确定是否含有的阳离子有K+,
③要确定其存在可补充做的实验是 ;
④肯定不存在的阴离子有 .
(2)经检测,该溶液中含有大量的Cl﹣、Br﹣、I﹣,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl﹣、Br﹣、I﹣的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
Cl2的体积
(标准状况) 2.8L 5.6L 11.2L
n(Cl﹣) 1.25mol 1.5mol 2mol
 n(Br﹣) 1.5mol 1.4mol 0.9mol
n(Br﹣) 1.5mol 1.4mol 0.9mol
n(I﹣) a mol 0 0
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为 .
②原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为 .

考点: 离子方程式的有关计算;离子反应发生的条件;常见离子的检验方法.
专题: 计算题.
分析: (1)根据产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,一开始无沉淀,溶液中一定含有H+,能够与氢离子反应的离子不能存在;加NaOH有气体放出,则推断溶液中一定含有NH4+,沉淀最后完全消失,则溶液中只含有Al3+,不同金属阳离子灼烧呈现不同的焰色,据此解答;
(2)碘离子与溴离子的还原性强弱顺序为:I﹣>Br﹣,加入氯气2.8L时溶液中I﹣amol,则说明通入2.8L Cl2只发生:Cl2+2I﹣═I2+2Cl﹣,2.8L变成5.6L,消耗2.8L Cl2的物质的量为 =0.125mol,发生:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,根据反应方程式计算.
=0.125mol,发生:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,根据反应方程式计算.
解答: 解:(1)从产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(V)的关系的图示可以知道,开始时没有沉淀生成,说明溶液中氢离子,则一定没有ClO﹣、AlO2﹣;随后出现沉淀,且沉淀完全溶解了,说明沉淀是氢氧化铝,溶液中一定含有铝离子;氢氧化铝溶解前生成了 气体,该气体一定是氨气,故溶液中一定含有铵离子;不能确定是否含有钾离子,可以通过灼烧溶液,透过蓝色的钴玻璃观察焰色确定钾离子的存在;
气体,该气体一定是氨气,故溶液中一定含有铵离子;不能确定是否含有钾离子,可以通过灼烧溶液,透过蓝色的钴玻璃观察焰色确定钾离子的存在;
故答案为:H+、NH4+、Al3+;K+;焰色反应;CO3 2﹣、AlO2﹣;
(2)①由于碘离子与溴离子的还原性:I﹣>Br﹣,加入氯气2.8L时溶液中I﹣amol,2.8L变成5.6L,消耗2.8LCl2的物质的量为 =0.125mol,发生:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,Br﹣消耗0.1mol,需要氯气0.05mol,则说明开始通入2.8LCl2只发生:Cl2+2I﹣═I2+2Cl﹣,此时n(Cl2)=
=0.125mol,发生:Cl2 +2Br﹣═Br2+2Cl﹣,Cl2+2I﹣═I2+2Cl﹣,Br﹣消耗0.1mol,需要氯气0.05mol,则说明开始通入2.8LCl2只发生:Cl2+2I﹣═I2+2Cl﹣,此时n(Cl2)= =0.125mol,消耗n(I﹣)=2×0.125mol=0.25mol,生成n(Cl﹣)=2×0.125mol=0.25mol,此时n(Br﹣)=1.5mol,则说明原溶液中n(Br﹣)=1.5mol;
=0.125mol,消耗n(I﹣)=2×0.125mol=0.25mol,生成n(Cl﹣)=2×0.125mol=0.25mol,此时n(Br﹣)=1.5mol,则说明原溶液中n(Br﹣)=1.5mol;
故答案为:Cl2+2I﹣═I2+2Cl﹣;
②通入氯气2.8L时,n(Br﹣)=1.5mol,所以原溶液中n(Br﹣)=1.5mol;
n(Cl﹣)=0.125mol×2=0.25mol,n(I﹣)=0.25mol,故原溶液中n(Cl﹣)=1.25mol﹣0.25mol=1mol;
通入氯气5.6L时,n(Br﹣)=1.5mol﹣1.4mol=0.1mol,n(I﹣)=0.25mol﹣0.1mol=0.1 5mol,故原溶液中n(I﹣)=0.25mol+0.15mol=0.4mol;
5mol,故原溶液中n(I﹣)=0.25mol+0.15mol=0.4mol;
故原溶液中Cl﹣、Br﹣、I﹣的物质的量浓度之比为:1:1.5:0.4=10:15:4;
故答案为:10:15:4.
点评: 本题考查离子的判断和有关计算,准确分析图标数据是解题关键,题目难度中等,注意根据离子的还原性以及表中数据判断反应的程度,结合方程式计算.


科目:高中化学 来源: 题型:
在密闭容器,一定条件下进行反应,mA(s)+nB(g) pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是()
pC(g)+qD(g) 若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是()
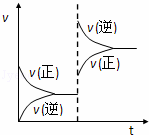
A. 逆反应是吸热反应 B. 正反应是吸热反应
C. m+n>p+q D. m+n<p+q
查看答案和解析>>
科目:高中化学 来源: 题型:
在c(H+):c(OH﹣)=1:2的水溶液中能大量共存的离子组是()
A. K+、Al3+、HCO3﹣、SO42﹣ B. Ca2+、NH4+、CO32﹣、Cl﹣
C. Na+、K+、NO3﹣、ClO﹣ D. Na+、Fe2+、I﹣、SO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关原子结构和元素周期律的表述正确的是()
①原子序数为15的元素的最高化合价为+3
②第ⅦA族元素是同周期中非金属性最强的元素
③第ⅥA族元素的原子最高正价等于主族序数
④原子序数为12的元素位于元素周期表的第三周期第ⅡA族.
A. ①② B. ①③ C. ②④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验现象预测正确的是()
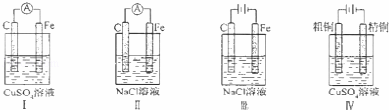
A. 实验Ⅰ:电流表A指针偏转,碳棒上有气泡冒出
B. 实验Ⅱ:电流表A指针偏转,铁极上有无色气体产生
C. 实验Ⅲ:碳棒上有无色气体产生,铁极上有黄绿色气体产生
D. 实验IV:粗铜溶解,精铜上有红色固体析出
查看答案和解析>>
科目:高中化学 来源: 题型:
向10mL 0.1mol•L﹣1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是()
A. x=10时,溶液中有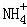 、Al3+、
、Al3+、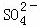 ,且c(
,且c(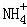 )=c(Al3+)
)=c(Al3+)
B. x=20时,溶液中所发生的反应离子方程式为:Al3++2SO42﹣+2Ba2++4OH﹣═2BaSO4↓+AlO2﹣+2H2O
C. x=30时,溶液中有Ba2+、 、OH﹣,且c(OH﹣)>c(
、OH﹣,且c(OH﹣)>c( )
)
D. 滴加过程中,生成沉淀的最大物质的量为0.003mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是()
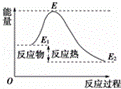
A. 反应物分子(或离子)间的每次碰撞是反应的先决条件
B. 反应物的分子的每次碰撞都能发生化学反应
C. 活化分子具有比普通分子更高的能量,催化剂能够减低活化能的数值
D. 活化能是活化分子的平均能量与所有分子平均能量之差,如图所示正反应的活化能为E﹣E1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com