
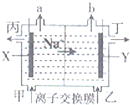
 ��֪���з�Ӧ����Ӧ�������������Ӧ���Ũ�Ⱥͷ���ʽ�и����ʵĻ�ѧ������������ȥ����
��֪���з�Ӧ����Ӧ�������������Ӧ���Ũ�Ⱥͷ���ʽ�и����ʵĻ�ѧ������������ȥ����| 0.112L |
| 22.4L/mol |
| 0.01mol |
| 0.1L |
| ||
| ||
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2Al3++3SO42-+3Ba2++6OH-=2Al��OH��3��+3BaSO4�� |
| B��Al3++SO42-+Ba2++3OH-��Al��OH��3��+BaSO4�� |
| C��2Al3++3SO42-+3Ba2++8OH-��2AlO2-+3BaSO4��+4H2O |
| D��Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| a | b | c | d | e | |||
| f | g |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH=3����Һ��Ca2+��CH3COOH��Br-��Na+ |
| B��ˮ�����c��H+��=1��10-13mo1?L-1����Һ��Na+��K+��SO42-��CO32- |
| C�����д���Fe3+����Һ��Na+��Mg2+��NO3-��SCN- |
| D�����д���NO3-����Һ��NH4+��H+��SO42-��I- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���鷽�� | ������ | ��ɫ�� | ���巨 |
| �ж����� | ��Ӧ���г������ɻ��ܽ� | ��Ӧ������ɫ�仯 | ��Ӧ������������ |
| A��CO32----------------���巨 |
| B��SO42------------------������ |
| C��H+--------------------��ɫ�� |
| D��Cl---------------------���巨 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
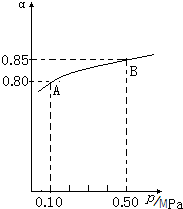 SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ��
SO2��NOx�ڻ�ѧ��ҵ������Ҫ��;��Ҳ�Ǵ�����Ⱦ����Ҫ��Դ�����������ò��أ�Ԥ�������������ǵ�ǰ��ҵ�Ϻͻ������������о�����Ҫ����֮һ��| ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ������ڻ�ѧѧ�Ƶķ�չ�����˷dz���Ҫ�����ã���ͼ��ij��Ӧ���ܱ������з�Ӧǰ��ķ���״��ʾ��ͼ��?�͡�ֱ��ʾ��ͬ��ԭ�ӣ��Դ˷�Ӧ�ķ����ȷ���ǣ�������
������ڻ�ѧѧ�Ƶķ�չ�����˷dz���Ҫ�����ã���ͼ��ij��Ӧ���ܱ������з�Ӧǰ��ķ���״��ʾ��ͼ��?�͡�ֱ��ʾ��ͬ��ԭ�ӣ��Դ˷�Ӧ�ķ����ȷ���ǣ�������| A�����Ϸ�Ӧ | B��������ԭ��Ӧ |
| C�����淴Ӧ | D��ȡ����Ӧ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com