
| A. | 氮气化学性质通常不活泼,可将炽热的镁粉放在氮气中冷却 | |
| B. | 明矾溶于水能形成胶体,可用于自来水的杀菌消毒 | |
| C. | 常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸 | |
| D. | 金属钠具有强还原性,可用与TiCl4溶液反应制取金属Ti |
分析 A.氮气与镁在加热条件下会反应;
B.明矾不能用于杀菌消毒;
C.常温下Fe遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生;
D.钠易与溶液中的水反应.
解答 解:A.加热条件下,氮气与镁反应生成氮化镁,所以炽热的镁粉不可放在氮气中冷却,故A错误;
B.明矾溶于水能形成氢氧化铝胶体,具有吸附性,能够吸收水中固体杂质颗粒,可以净水,不具有氧化性,不用于自来水的杀菌消毒,故B错误;
C.常温下Fe遇浓硝酸发生钝化,生成致密的氧化膜阻止反应的进一步发生,则可用铁质容器贮运浓硝酸,故C正确;
D.钠易与溶液中的水反应,不能置换出溶液中的金属,故D错误;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
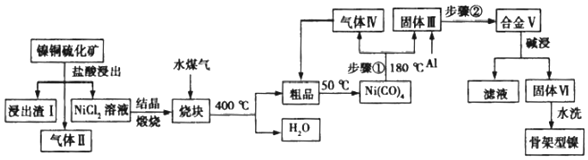
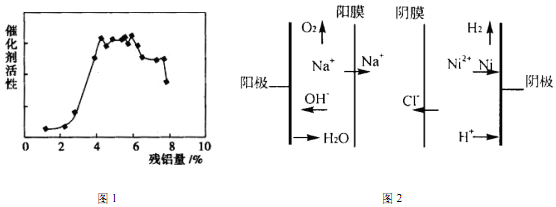
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 .
. .此空多余
.此空多余 可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$
可用于合成有机高分子色素,根据Claisen缩合反应,设计以甲醛和乙醛为原料合成聚丙烯醛的路线.合成路线流程图示例如下:H2C═CH2$→_{催化剂加热}^{HBr}$CH3CH2Br$→_{加热}^{NaOH溶液}$CH3CH2OH.HCHO+CH3CHO$→_{△}^{NaOH(aq)}$nCH2═CHCHO$→_{△}^{催化剂}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质为NaCl溶液,正极反应为H2+2e-=2H+ | |
| B. | 电解质为NaOH溶液,正极反应为O2+2e-=2OH- | |
| C. | 电解质为HCl溶液,正极反应为O2+4e-+4H+=2H2O | |
| D. | 电解质为Na2CO3溶液,正极反应为H2+2e-+CO32-=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体中一定含金属阳离子 | |
| B. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| C. | 分子晶体的熔点不一定比金属晶体的熔点低 | |
| D. | 在共价化合物分子中,各原子都形成8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=9.25、浓度均为0.1 mol•L-1的NH4C1、NH3•H2O混合溶液:c(NH4+)+c(H+)>c(NH3•H2O)+c(OH-) | |
| B. | 0.1mol/LH2SO4溶液与0.1mol/LNaOH溶液等体积混合:c(H+)═c(SO42-)+c(OH-) | |
| C. | 向0.10mol•L-1NaHSO3溶液中通NH3至pH=7:c(Na+)>c(SO32-)>c(NH4+) | |
| D. | CO2通入KOH溶液,当由水电离的H+浓度为10-7mol/L,一定存在:c(K+)=2c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A 原子最外层电子数比 B 原子的最外层电子数少 | |
| B. | A 原子电子层数比 B 原子的电子层数多 | |
| C. | 常温时,A能从酸中置换出氢,而B不能 | |
| D. | 1molA从酸中置换生成的 H2比 1mol B从酸中置换生成的 H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-=CuS↓ | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3- | |
| D. | 向KA1(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com