
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是 。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
 2CO(g) △H=+172.5kJ?mol-1
2CO(g) △H=+172.5kJ?mol-1 CO2(g)+H2(g)的焓变△H=
CO2(g)+H2(g)的焓变△H=  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨做电极,该电池负极反应式为: 。 CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:
CO(g)+H2O(g) CO2(g)+H2(g),得到如下数据:| 温度/℃ | 起始量/mol | 平衡量/mol[学科 | 达到平衡所x需时间/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。
2NH3(g) ΔH=-92.4kJ?mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如下图。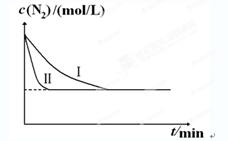

(15分)(1)A D(2分) (2)-41.2kJ?mol-1 (2分)
(3)CH3OH(g) +H2O-6e-= CO2 +6H+ (2分)14(2分)
(4)
3CO2 + 5OH- = 2CO32- + HCO3- + 2H2O
(5)①使用催化剂(1分)。
② 
(2分,纵坐标起点可以大于0。Ⅲ比Ⅰ快1分,比Ⅰ少1分)
解析试题分析:⑴C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,是吸热反应,升高温度平衡正向移动,A正确,增加碳的的用量不能增加反应物浓度,平衡不移动,B不正确,催化剂只加快反应速率,不能使平衡移动,C不正确,吸收剂吸收CO,减小生成物浓度,平衡正向移动,D正确,选A D。⑵根据盖斯定律:①C(s)+ H2O(g)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,是吸热反应,升高温度平衡正向移动,A正确,增加碳的的用量不能增加反应物浓度,平衡不移动,B不正确,催化剂只加快反应速率,不能使平衡移动,C不正确,吸收剂吸收CO,减小生成物浓度,平衡正向移动,D正确,选A D。⑵根据盖斯定律:①C(s)+ H2O(g)  CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,②C(s)+ CO2(g)
CO(g) +H2(g) ΔH=" +131.3" kJ?mol-1,②C(s)+ CO2(g) 2CO(g) △H=+172.5kJ?mol-1,①―②得:CO(g)+H2O(g)
2CO(g) △H=+172.5kJ?mol-1,①―②得:CO(g)+H2O(g) CO2(g)+H2(g)ΔH=―41.2kJ?mol-1 ,答案:―41.2kJ?mol-1。⑶甲醇燃料电池,甲醇作还原剂,在负极上发生氧化反应,用稀硫酸作电解质溶液,电极反应为:CH3OH(g) +H2O-6e-= CO2 +6H+ 。2NaCl+2H2O
CO2(g)+H2(g)ΔH=―41.2kJ?mol-1 ,答案:―41.2kJ?mol-1。⑶甲醇燃料电池,甲醇作还原剂,在负极上发生氧化反应,用稀硫酸作电解质溶液,电极反应为:CH3OH(g) +H2O-6e-= CO2 +6H+ 。2NaCl+2H2O 2NaOH+H2↑+Cl2↑, CH3OH(g) ~ 6e- ~ 6NaOH,0.01molCH3OH完全放电,生成0.06molNaOH,c(OH―)= 0.06mol/0.06L=1mol/l,pH="-lg" c(H+ )=" -lg" 10-14=14.答案:CH3OH(g) +H2O-6e-= CO2 +6H+ 、 14;⑷
2NaOH+H2↑+Cl2↑, CH3OH(g) ~ 6e- ~ 6NaOH,0.01molCH3OH完全放电,生成0.06molNaOH,c(OH―)= 0.06mol/0.06L=1mol/l,pH="-lg" c(H+ )=" -lg" 10-14=14.答案:CH3OH(g) +H2O-6e-= CO2 +6H+ 、 14;⑷
平衡常数为
n(CO2)=0,6mol;n(OH-)=0.2ml×5mol·L-1=1mol;
CO2+2OH-=CO32-+H2O;CO2+OH-=HCO3-;
依据反应n(CO2):n(OH-)=0.6:1=3:5可知反应生成产物有碳酸钠和碳酸氢钠,根据物质的量之比,利用直平法得到离子方程式:3CO2+5OH-=2CO32-+HCO3-+2H2O;
故答案为:0.17 和3CO2+5OH-=2CO32-+HCO3-+2H2O;
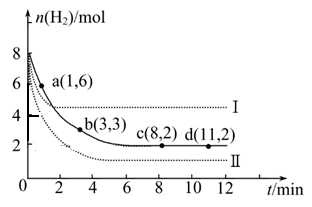
⑸①N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ?mol-1,为体积减小的反应,与实验Ⅰ比较,平衡不移动,不可能是改变压强,又反应速率加快,实验Ⅱ改变的条件为使用催化剂。答案:使用催化剂;
2NH3(g) ΔH=-92.4kJ?mol-1,为体积减小的反应,与实验Ⅰ比较,平衡不移动,不可能是改变压强,又反应速率加快,实验Ⅱ改变的条件为使用催化剂。答案:使用催化剂;
②实验Ⅲ比实验Ⅰ的温度要高,其它条件相同,速率加快,平衡逆向移动,实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图
考点:考查了反应能量守恒的分析判断,化学平衡三段式计算方法,转化率的计算应用,平衡影响因素,平衡移动原理的应用,热化学方程式的书写,反应产物判断的计算应用,题目难度中等.


科目:高中化学 来源: 题型:问答题
(19分)钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效。
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):
VOSO4 (水层)+ 2HM(有机层) VOM2(有机层) + H2SO4 (水层)
VOM2(有机层) + H2SO4 (水层)
步骤②中萃取时必须加入适量碱,其原因是 。
步骤③中X试剂为 。
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有 和 。
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜。
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② | 浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
某课外兴趣小组对H2O2的分解速率做了如下实验探究。
⑴ 下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:
用10mL H2O2制取150mLO2所需的时间(秒)
① 该小组在设计方案时,考虑了浓度、a: 、b: 等因素对过氧化氢分解速率的影响。
② 从上述影响H2O2分解速率的因素a和b中任选一个,说明该因素对该反应速率的影响:
。
⑵ 将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木
条测试。测定结果如下:
| 催化剂(MnO2) | 操作情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 混合不振荡 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g)
CO(g)+3H2(g)……Ⅰ CO(g)+2H2(g) CH3OH(g) ……Ⅱ。
CH3OH(g) ……Ⅱ。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100L反应室,在一定条件下发生反应I,CH4的平衡转化率与温度、压强的关系如图。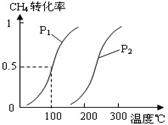
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为 。
②图中的P1 P2(填“<”、“>”或“=”),100℃时平衡常数的值为 。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3a mol H2的混合气体在催化剂作用下,自发反应Ⅱ,生成甲醇。
③该反应的△H 0;若容器容积不变,下列措施可增加甲醇产率的是 。
| A.升高温度 | B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 | D.再充入1mol CO和3mol H2 |
| 实验编号 | T(℃) | n(CO)/n(H2) | P(Mpa) |
| i | 150 | 1/3 | 0.1 |
| ii | | | 5 |
| iii | 350 | | 5 |
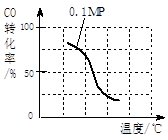
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
(I)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤:
①CaBr2+H2O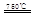 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg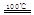 HgBr2+H2
HgBr2+H2
③HgBr2+_____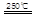 _____ + ④2HgO
_____ + ④2HgO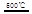 2Hg+O2↑
2Hg+O2↑
请你根据“原子经济”的思想完成上述步骤③的化学方程式:________ _。
根据“绿色化学”的思想评估该方法制H2的主要缺点:________ __。
(II)氢气常用生产水煤气的方法制得。CO(g)+H2O(g) CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
在850℃时,K=1。
(1)若升高温度到950℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3.0molH2O、1.0molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向___________(填正反应或逆反应)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是__________。
(3)在850℃时,若x="5.0" mol,其它物质的投料不变,当上述反应达到平衡后,求H2的体积分数(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
工业上“固定”和利用CO2能有效地减轻“温室’效应。有一种用CO2生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH =-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是
| A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1 |
| B.容器内压强保持不变 |
| C.H2的消耗速率与CH3OH的消耗速率之比为3∶1 |
| D.容器内的密度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
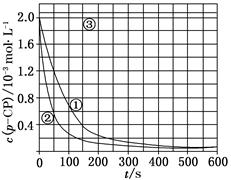
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计] 控制p-CP的初始浓度相同,恒定实验温度在298 K或313 K(其余实验条件见下表),设计如下对比实验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验编号 | 实验目的 | T/K | pH | c/10-3 mol·L-1 | |
| H2O2 | Fe2+ | ||||
| ① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
| ② | 探究温度对降解反应速率的影响 | | | | |
| ③ | | 298 | 10 | 6.0 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,在0.1mol/L的碳酸钠溶液中,下列离子浓度的关系式正确的是
A.2c(H2CO3)+c(HCO )+c(H+) = c(OH-) )+c(H+) = c(OH-) |
B.c(Na+) = c(HCO )+c(H2CO3)+ 2c(CO )+c(H2CO3)+ 2c(CO ) ) |
C.c(Na+)>c(H+)>c(OH-)>c(CO ) ) |
D.c(Na+)+c(H+) = c(HCO )+c(OH-)+ 2c(CO )+c(OH-)+ 2c(CO ) ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com