
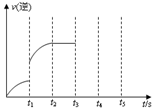
 一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$
一定温度下在体积为5L的密闭容器中发生某可逆反应,其化学平衡常数表达式为:$K=\frac{{c(CO)•c({H_2})}}{{c({H_2}O)}}$分析 (1)根据化学平衡常数表达式知,生成物是CO和氢气,反应物有水,根据元素守恒知,反应物还含有C;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(3)改变条件时逆反应速率增大,随着反应的进行,逆反应速率逐渐增大,说明平衡正向移动.
解答 解:(1)根据化学平衡常数表达式知,生成物是CO和氢气,反应物有水,根据元素守恒知,反应物还含有C,所以该可逆反应为C(s)+H2O(g)?CO(g)+H2(g),故答案为:C(s)+H2O(g)?CO(g)+H2(g);
(2)该反应前后气体计量数之和增大,所以恒温恒容条件下容器中气体的平均相对分子质量、气体的分子总数或混合气体的压强、密度都改变,当这些量不再随时间变化时该反应达到平衡状态,
故答案为:压强或密度;
(3)改变条件时逆反应速率突然增大,随着反应的进行,逆反应速率增大,说明平衡正向移动,
a.减小H2浓度,逆反应速率减小,故a选;
b.使用催化剂,逆反应速率增大,但是平衡不移动,故b选;
c.碳与水蒸气的反应属于吸热反应,升高温度,正向移动,正逆反应速率都增大,故c不选;
故答案为:ab.
点评 本题考查化学平衡图象分析、化学平衡状态的判断,明确化学平衡状态的判断方法和外界条件对反应速率、化学平衡的影响是解本题关键,会根据图象曲线变化确定反应方向,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;A、C、D形成的化合物
;A、C、D形成的化合物 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
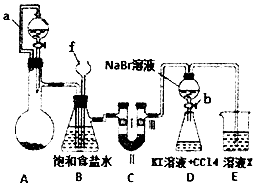 实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:
实验是化学研究的重要方法之一,某同学为了制备氯气并探究氯气等物质的相关性质,设计如图所示的实验方案:| ① | ② | ③ | ④ | |
| I | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| II | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| II! | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等.
过渡元素铁可形成多种配合物,如:[Fe(CN)6]4-、Fe(OCN)64-等. Mg2FeH6+Mg.
Mg2FeH6+Mg.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| B. | 检验铵盐方法:加氢氧化钠溶液,加热,用蘸有浓硫酸的玻璃棒靠近瓶口 | |
| C. | .制取硝酸铝方法:用AlCl3溶液和氨水反应,过滤得沉淀,再加稀HNO3 | |
| D. | 等物质的量的Na2CO3和NaHCO3分别与足量盐酸反应,后者放出的CO2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铵的电子式: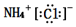 | B. | 中子数为18的硫原子:${\;}_{16}^{18}$S | ||
| C. | 水分子的球棍模型: | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com