
【题目】高锰酸钾常用作消毒杀菌、水质净化剂等。某小组用软锰矿(主要含MnO2,还含有少量SiO2、Al2O3、Fe2O3等杂质)模拟工业制高锰酸钾流程如下。试回答下列问题。
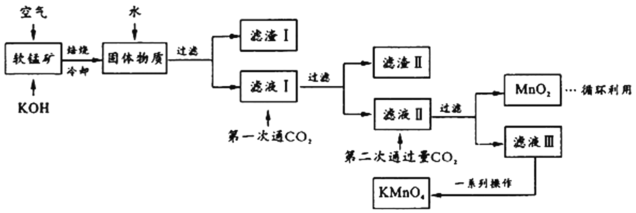
(1)配平焙烧时化学反应:________MnO2+________+________O2![]() ________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
________K2MnO4+________H2O;工业生产中采用对空气加压的方法提高MnO2利用率,试用碰撞理论解释其原因___________________________。
(2)滤渣Ⅱ的成分有_________(化学式);第一次通CO2不能用稀盐酸代替的原因是_____________。
(3)第二次通入过量CO2生成MnO2的离子方程式为________________________。
(4)将滤液Ⅲ进行一系列操作得KMnO4。
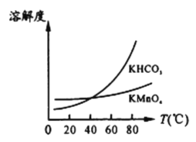
由图可知,从滤液Ⅲ得到KMnO4需经过__________、___________、洗涤等操作。
(5)工业上按上述流程连续生产。含MnO2 a%的软锰矿1吨,理论上最多可制KMnO4____________吨。(保留到小数点后三位)
(6)利用电解法可得到更纯的KMnO4用惰性电极电解滤液Ⅱ。
①电解槽阳极反应式为________________________________。
②阳极还可能有气体产生,该气体是____________。
【答案】2 4KOH 1 2 2 加压增大了氧气浓度,使单位体积内的活化分子数增加,有效碰撞次数增多,反应速率加快,使MnO2反应更充分 Al(OH)3、H2SiO3 稀盐酸能够溶解Al(OH)3,不易控制稀盐酸的用量 3MnO42-+4CO2+2H2O=MnO2↓+2MnO4-+4HCO3- 蒸发结晶 趁热过滤 0.018a MnO42--e-=MnO4- O2
【解析】
分析整个流程,将主要成分为MnO2的软锰矿与KOH混合在空气中焙烧,冷却得到固体物质,将固体物质溶于水过滤得到滤渣I和滤液I,滤液I中应含有K2SiO3、KAlO2、K2MnO4等溶质,滤渣I为Fe2O3;向滤液I中第一次通入CO2与K2SiO3、KAlO2发生反应,过滤得到滤渣Ⅱ和滤液Ⅱ,滤渣Ⅱ为Al(OH)3、H2SiO3;滤液Ⅱ含有KHCO3、K2MnO4等溶质;向滤液Ⅱ中第二次通入过量CO2,再次过滤得到滤液Ⅲ和MnO2,则可以推断滤液Ⅲ中含有KMnO4和KHCO3,再经过一系列操作得到较纯的KMnO4,MnO2可以作为循环利用的物质。
(1)在焙烧时MnO2与KOH在空气中O2的作用下反应得到K2MnO4和H2O,反应为氧化还原反应,Mn化合价升高2,O化合价降低2,根据电子转移数守恒,所以在MnO2前面配上2,O2前面配上1,根据Mn元素守恒,在K2MnO4前面配上系数2,再根据K元素守恒,在KOH前面配上4,最后根据H元素守恒,在H2O前面配上2,该反应的化学方程式为:2MnO2+4KOH+O2![]() 2K2MnO4+H2O;
2K2MnO4+H2O;
工业生产中采用对空气加压的方法提高MnO2利用率,这是由于加压增大了氧气浓度,使单位体积内的活化分子数增加,有效碰撞数增多,反应速率加快,使MnO2反应更充分;
(2)根据上述分析可知滤渣Ⅱ中含有的物质有Al(OH)3,H2SiO3;第一次通CO2不能用稀盐酸代替,这是由于稀盐酸酸性较强,可溶解Al(OH)3变为可溶性的AlCl3,稀盐酸的用量不易控制,时溶液中便会再次混入Al3+;
(3)第二次通入过量CO2生成MnO2,溶液中原先是K2MnO4,再第二次通入过量的CO2时发生歧化反应生成MnO2和KMnO4,此时CO2被转化为HCO3-,该反应为氧化还原反应,则反应的离子方程式为:3MnO42-+4CO2+2H2O=MnO2↓+2MnO4-+4HCO3-;
(4)将滤液Ⅲ进行一系列操作得KMnO4,此时溶液中还存在KHCO3,根据溶解度随温度变化的图象分析,随着温度升高,二者溶解度均不断增大,在40℃附近时二者溶解度相等,超过这一温度时,KHCO3溶解度不断增大,KMnO4溶解度则增大较缓慢,所以从溶液中提取较纯的KMnO4,需要蒸发结晶,趁热过滤,洗涤等操作;
(5)工业上按上述流程连续生产,含MnO2 a%的软锰矿1吨,理论上第一步完全转化为K2MnO4,第二步转化为KMnO4时则是发生歧化反应,由于歧化反应产物得到MnO2可以循环使用,所以理论最多产量则是根据Mn元素守恒完全生成KMnO4的量,m(KMnO4)=![]() =0.018a t;
=0.018a t;
(6)①电解池中阳极发生氧化反应,用惰性电极电解滤液Ⅱ,滤液Ⅱ中含有MnO42-,MnO42-失去电子变为MnO4-,则阳极的电极反应为:MnO42--e-=MnO4-;
②阳极还可能发生电解水的相关反应,水电离产生的OH-失去电子产生O2,发生的电极反应有2H2O-4e-=O2↑+4H+,因此阳极上产生的气体为O2。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:![]()
B.W与X形成的化合物溶于水后溶液呈碱性
C.气态氢化物的热稳定性:![]()
D.最高价氧化物的水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)2NO2(g)△H>0,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是

A.恒温恒容下,再向B点体系充入N2O4,NO2的体积分数增大
B.图中A、C两点气体的颜色:A浅,C深
C.图中A、C两点气体的平均相对分子质量:A>C
D.温度T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米材料一直是人们研究的重要课题,例如纳米级Fe粉表面积大,具有超强的磁性、高效催化性等优良的性质。
Ⅰ.实验室采用气相还原法制备纳米级Fe,其流程如图所示::
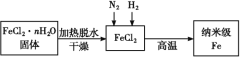
(1)纳米级Fe和稀盐酸反应的离子方程式为_____。
(2)如何将FeCl2·nH2O固体加热脱水制得无水FeCl2:____(用简要文字描述)。
(3)生成纳米级Fe的化学方程式为____。
Ⅱ.查阅资料:在不同温度下,纳米级Fe粉与水蒸气反应的固体产物不同,温度低于570℃时生成FeO,高于570℃时生成Fe3O4。甲同学用图甲所示装置进行纳米级Fe粉与水蒸气反应的实验,乙同学用图乙所示的装置进行纳米级Fe粉与水蒸气的反应并验证产物。
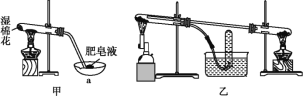
(4)甲装置中纳米级Fe粉与水蒸气反应的化学方程式是_____。
(5)甲装置中仪器a的名称为_____。
(6)丁同学称取5.60gFe粉,用乙装置反应一段时间后,停止加热。将试管内的固体物质在干燥器中冷却后,称得质量为6.88g,则丁同学实验后的固体物质中氧化物的质量分数为_____(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分析正确的是( )
A.异丁烷的二氯代物有4种
B.误食少量硫酸铜,可大量饮入牛奶解毒
C.石蜡油分解产物均能使酸性KMnO4溶液褪色
D.CH3-CH=CH2中所有原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 向氨水中通入过量SO2:NH3·H2O+SO2===NH4++HSO3-
B. Si与NaOH溶液反应:Si+2OH-+H2O===SiO32-+H2↑
C. 电解MgCl2溶液:2H2O+2Cl-![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D. Ba(OH)2溶液中滴入NaHSO4溶液至Ba2+恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国具有悠久的历史,在西汉就有湿法炼铜(Fe+CuSO4=Cu+FeSO4),试回答下列问題。
(1)Cu2+的未成对电子数有_____个,H、O、S电负性由大到小的顺序为______________________。
(2)已知[Cu(NH3)4]SO4是一种配合物。
①[Cu(NH3)4]SO4中化学键类型有______________,[Cu(NH3)4]2+的结构简式为_________________。阴离子中心原子杂化类型为____________________。
②NH3、H2O、HF的沸点由高到低为_________________。
(3)铁铜合金晶体类型为________________;铁的第三(I3)和第四(I4)电离能分别为2957 kJ/mol、5290 kJ/mol,比较数据并分析原因________________。
(4)金铜合金的一种晶体结构为立方晶型,如图所示。
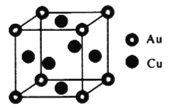
①该合金的化学式为_______________。
②已知该合金的密度为d g/cm3,阿伏加徳罗常数值为NA,则该晶胞的棱长为__________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Fe2+、Br-、I-各0.1 mol 的溶液中通入Cl2。通入Cl2的体积(标准状况)与溶液中某种离子(用Q表示)的物质的量的关系如图所示,下列说法中正确的是

A.Q是I-
B.a点时溶液中的阳离子有Fe2+和Fe3+(不考虑H+)
C.b点时溶液中的阴离子只有Cl-(不考虑OH-)
D.ab区间发生的反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com