
【题目】如图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )
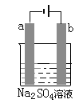
A. 逸出气体的体积a电极的小于b电极的
B. 一电极逸出无味气体,另一电极逸出刺激性气味气体
C. a电极附近呈蓝色,b电极附近出现红色
D. a电极附近呈红色,b电极附近出现蓝色
【答案】C
【解析】
Na2SO4水溶液中,存在Na+、H+、OH-、SO42-,得电子能力:H+> Na+;失电子能力:OH-> SO42-,则电解Na2SO4的实质是电解水。
A.a、b电极反应式分别为4H2O+4e-=2H2↑+4OH-、2H2O-4e-=O2↑+4H+,相同温度和压强下,a电极生成气体体积大于b电极,A错误;
B.阳极上生成氧气、阴极上生成氢气,氧气和氢气都是无色无味气体,B错误;
C.a、b电极反应式分别为4H2O+4e-=2H2↑+4OH-、2H2O-4e-=O2↑+4H+,所以a电极附近溶液呈碱性、b电极附近溶液呈酸性,则a电极溶液呈蓝色、b电极溶液呈红色,C正确;
D.根据C知,a电极溶液呈蓝色、b电极溶液呈红色,D错误;
答案为C


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)已知甲烷和汽油(可用 C8H18表示)的燃烧的热化学方程式:
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJ/mol;
C8H18(l)+![]() O2(g)═8CO2(g)+9H2O(l)△H=﹣5472kJ/mol;
O2(g)═8CO2(g)+9H2O(l)△H=﹣5472kJ/mol;
则等质量的甲烷和汽油燃烧,产生的热量比较多的是___________(填“甲烷”或“汽油”)
(2)SiH4是一种无色气体,遇到空气能发生爆炸性自燃,生成 SiO2和液态 H2O。已知室温下 2gSiH4自燃放出热量 89.2kJ.SiH4自燃的热化学方程式为____________________.
(3)1molH2(g)和1mol Cl2(g)在一定条件下反应生成2 mol HCl(g),放出184.5kJ的热量,已知断裂1molH2(g)中的H-H和1mol Cl2(g)中的Cl-Cl分别需要吸收436.4kJ和242.7kJ的能量,则1mol HCl分子中的化学键形成时释放_________kJ的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,进行下列反应. 2A(g)+B(g)+C(s) ![]() D(g)+E(g)(正反应吸收热量)达到平衡后,下列说法中正确的是( )
D(g)+E(g)(正反应吸收热量)达到平衡后,下列说法中正确的是( )
A. 若恒温定容情况下,充入一些稀有气体压强增大,E的物质的量将不变
B. 若恒温定压条件下,加入C(s),则B的转化率将增大
C. 若定容升温,在新平衡体系中气体平均相对分子质量将减小
D. 在温度、压强和容积都相同时,在另一密闭容器中加入2 mol A、1 mol B、1 molC,平衡时两个容器中D和E的浓度分别相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量NH4NO3 ;②适量NaCl;③适量氨水;④适量NaOH
A. ①② B. ②③ C. ①③ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用如图所示装置制取氯气,并收集氯气进行实验。
请完成下列问题:
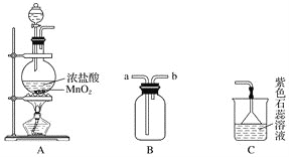
(1)装置A中发生反应的离子方程式为______________________________________。
(2)装置B如图中所示正放,则连接A的接口是________(填序号)。
(3)实验中可观察到装置C中紫色石蕊溶液的现象是__________________,其原因______________________________________________________________________。
(4)取出B中的集气瓶进行氯气与铜的反应实验,应该进行的操作是______________,然后立刻放入充满氯气的集气瓶中。实验中有同学提出应该在集气瓶底先放少量的水或细沙,你认为__________(填“需要”或“不需要”)放,理由是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向如图所示带有可移动活塞的密闭容器中充入2 L SO2 和1 L O2 的混合气体,发生如下反应2 SO2 (g) + O2 (g) ![]() 2 SO3 (g) 。
2 SO3 (g) 。

(1)若活塞可自由移动,平衡后,活塞停止在“2.1”处,则该反应中SO2 的转化率为_______。
(2)若使活塞固定在“3”处,向容器中充入4L SO2和2L O2,反应进行到某一时刻时, SO2和O2的转化率之比为 _____
(3)若使活塞固定在“3”处的三个相同容器,开始时,充入容器的起始物质分别是①2L SO2和1L O2 ;②2 L SO3 (g) 和 1 L N2 ;③1 L SO2 、1 L O2 和 1 L SO3 (g)。上述三种投料方式的反应体系均达到平衡后,则三种情况容器中SO3 (g)的物质的量浓度大小关系是__________(用序号和“<”、“=”、“>”表示)。
(4)向(1)平衡后的容器中充入0.2 mol 的SO3,活塞移动后再次达到平衡时,测得此过程中从外界共吸收了1.96 kJ 的热量。写出SO2 发生氧化反应的热化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把A、B、C、D四块金属片浸入稀硫酸中,分别用导线两两相连可以组成原电池。A、B相连时A为负极;C、D相连时,电流由D→C;A、C相连时,C极上产生大量气泡,B、D相连时,D极发生氧化反应。这四种金属的活动性顺序是
A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com