
| A. | 煤干馏后的产物可以制造氮肥 | |
| B. | 可在周期表的过渡元素中寻找半导体材料 | |
| C. | 可用新制的氢氧化铜检验葡萄糖 | |
| D. | 可用氯气制备漂白粉 |
分析 A.依据煤干馏产物中含有氨气解答;
B.在金属与非金属性交界处寻找半导体材料;
C.葡萄糖含有醛基能够还原新制备的氢氧化铜;
D.氯气与石灰乳反应生成氯化钙、次氯酸钙和水.
解答 解:A.煤干馏产物中含有氨气,氨气可以用作氮肥,故A正确;
B.在金属与非金属性交界处寻找半导体材料,在过渡元素中寻找催化剂、耐高温、耐腐蚀的合金材料,故B错误;
C.葡萄糖含有醛基能够还原新制备的氢氧化铜,生成红色氧化亚铜,所以可以用新制的氢氧化铜检验葡萄糖,故C正确;
D.氯气与石灰乳反应生成氯化钙、次氯酸钙和水,氯化钙和次氯酸钙为漂白粉主要成分,故D正确;
故选:B.
点评 本题为综合题,考查了煤干馏的产物、醛基与新制氢氧化铜的反应、漂白粉的制备、元素周期表的应用,题目难度不大,掌握基础是解题关键.


科目:高中化学 来源: 题型:解答题
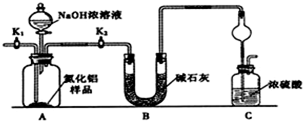
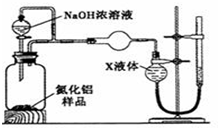
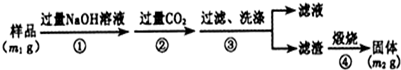
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
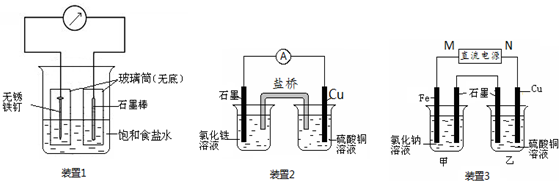
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 解释 | |
| A | 100℃0.1mol/L Na2SO4溶液pH=6.2 | H2O=H++OH- |
| B | 0.1mol/L CH3COOH的pH=3 | CH3COOH?CH3COO-+H+ |
| C | 配制FeCl3溶液时加少量盐酸 | Fe3++3H2O?Fe(OH)3+3H+ |
| D | 随温度有升高,碳酸钠溶液pH增大 | CO32-+2H2O?H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L | |
| B. | 标况下,22.4L空气中含有NA个单质分子 | |
| C. | 1molCl2参加反应转移电子数一定为2NA | |
| D. | 在18g18O2中含有10NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
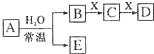 由短周期元素组成的中学常见无机物A、B、C、D、E、X 存在如在右图转化关系(部分生成物和反应条件略去),
由短周期元素组成的中学常见无机物A、B、C、D、E、X 存在如在右图转化关系(部分生成物和反应条件略去),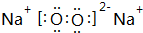 .将NaHCO3分解产生的气体(水蒸气和二氧化碳)用足量的A充分吸收得到固体甲,将甲溶于500mL 1mol/L的盐酸中,产生无色混合气体,溶液呈中性,则A的物质的量为0.25mol,混合气体在标准状况下的体积为2.8L(不考虑水蒸气的产生和其余气体的溶解).
.将NaHCO3分解产生的气体(水蒸气和二氧化碳)用足量的A充分吸收得到固体甲,将甲溶于500mL 1mol/L的盐酸中,产生无色混合气体,溶液呈中性,则A的物质的量为0.25mol,混合气体在标准状况下的体积为2.8L(不考虑水蒸气的产生和其余气体的溶解).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
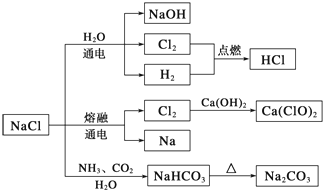
| A. | 25℃,NaHCO3在水中的溶解度比Na2CO3的大 | |
| B. | 石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 | |
| C. | 电解NaCl溶液的阳极产物为H2和NaOH | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com