
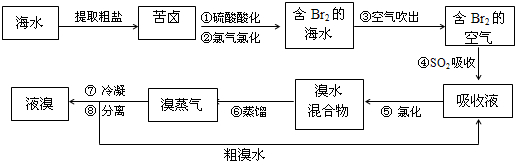


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
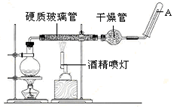 常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.
常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应. 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.请回答该实验中的问题.查看答案和解析>>
科目:高中化学 来源: 题型:
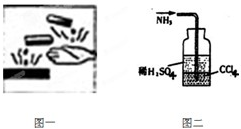 化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:
化学是一门以实验为基础的自然科学,进行化学实验时要采取正确的实验操作,注意实验安全:| 1 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经气化和液化两个物理过程后可变为清洁能源,这是煤综合利用的主要方法 |
| B、蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 |
| C、利用风能发电、使用太阳能热水器、应用无氟制冷剂均有利于降低大气中的二氧化碳 |
| D、塑料袋在全球“失宠”,有偿使用成为风尚,是因为塑料袋填埋占用土地,且难以降解,会造成“白色污染” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com