
| A. | 在浓海水中存在反应 Br2+H2O?HBr+HBrO | |
| B. | 纯碱溶液显碱性的原因是 CO32-+2H2O?H2CO3+OH- | |
| C. | 海水中提取溴还可用到的反应 Cl2+2Br-═2Cl-+Br2 | |
| D. | 纯碱吸收溴的主要反应是3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑ |
分析 A.Br2的性质与Cl2类似,能与水反应;
B.多元弱酸根分步水解;
C.氯气能把溴离子氧化为单质溴;
D.碳酸钠与单质溴反应生成溴化钠、溴酸钠、二氧化碳.
解答 解:A.Br2的性质与Cl2类似,能与水反应生成HBr和HBrO,则在浓海水中存在反应 Br2+H2O?HBr+HBrO,故A正确;
B.多元弱酸根分步水解,所以碳酸钠水解方程式为:CO32-+H2O?HCO3-+OH-,故B错误;
C.氯气能把溴离子氧化为单质溴,其反应为:Cl2+2Br-═2Cl-+Br2,故C正确;
D.碳酸钠与单质溴反应生成溴化钠、溴酸钠、二氧化碳,其反应为3Br2+3Na2CO3═5NaBr+NaBrO3+3CO2↑,故D正确.
故选B.
点评 本题考查了氧化还原反应、卤素单质及其化合物的性质,题目难度不大,侧重于基础知识的考查,注意把握多元弱酸根离子的水解特点.


科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | X与Y的转化率相等 | |
| C. | 该温度下的平衡常数约为9.3×10-3 | |
| D. | 重新建立平衡时Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 相同条件下与金属钠反应的速率,乙醇比乙酸慢 | |
| C. | 医用酒精属于混合物,醋酸是一元弱酸 | |
| D. | 乙酸乙酯在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、糖和醋都可做食品防腐剂 | |
| B. | 青蒿素可以用于治疗疟疾 | |
| C. | 鸡蛋清溶液中滴加醋酸铅溶液会发生盐析 | |
| D. | 油脂在碱性条件下的水解反应称为皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 利用燃气烧饭 |  古代制取陶瓷技术 |  萃取得到玫瑰精油 |  铁制品容易生锈 |
| 燃料的燃烧是氧化还原反应 | 用黏土制取陶瓷的原理属于化学变化 | 玫瑰花中萃取玫瑰精油属于化学变化 | 在船身上装锌块可避免船体遭受腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 现象 |
| Ⅰ | 先向2mL0.1mol•L-1FeCl2溶液中滴加KSCN溶液,再滴加新制氯水 | 滴加KSCN后溶液无明显变化, 加入氯水后溶液变成血红色. |
| Ⅱ | 先向2mL0.1mol•L-1FeCl3溶液中滴加KSCN溶液,再滴加0.1mol•L-1KI溶液 | 滴加KSCN溶液后,溶液变成血红色;滴加0.1mol•L-1KI溶液后,血红色无明显变化 |
| 编号 | 操作 | 现象 |
| Ⅲ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色;滴加KSCN溶液后,溶液变成血红色 |
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2mL0.1mol•L-1KI溶液中滴加1mL 0.1mol•L-1 FeCl3,溶液变黄色,取该溶液于两支试管中, 试管①中滴加滴加淀粉溶液(或CCl4), 试管②中滴加滴加铁氰化钾溶液. | 预期现象①溶液变蓝 (或溶液分层,下层溶液为紫红色),②出现特征蓝色沉淀. 结论Fe3+能与I-发生氧化还原反应,生成I2和Fe2+. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | ||
| T |
| A. | W、Z、T元素的原子半径及它们的最高价氧化的水化物的酸性均依次递增 | |
| B. | X、Y在自然界中都存在多种同素异形体,其氢化物的沸点一定是后者高 | |
| C. | ZY2、WY2可以形成同种类型的晶体,它们都有杀菌消毒的作用 | |
| D. | 根据元素周期律,可以推测Y、Z、T元素的单质与H2化合时的△H逐渐减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
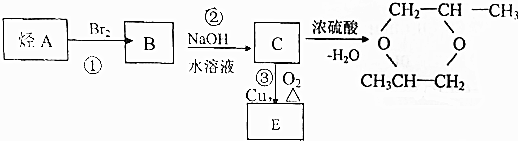
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com