
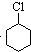
 (一氯环己烷)$→_{②}^{NaOH,乙醇,△}$
(一氯环己烷)$→_{②}^{NaOH,乙醇,△}$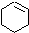 $→_{③}^{Br_{2}的CCl溶液}$
$→_{③}^{Br_{2}的CCl溶液}$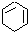 $\stackrel{④}{→}$
$\stackrel{④}{→}$ ,名称是环己烷
,名称是环己烷 .
. 分析 由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为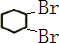 ,反应④为卤代烃的消去反应,生成环己二烯,结合对应物质的结构和性质以及题目要求解答该题.
,反应④为卤代烃的消去反应,生成环己二烯,结合对应物质的结构和性质以及题目要求解答该题.
解答 解:由合成路线可知,反应①为光照条件下的取代反应,所以A为 ,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为
,反应②为卤代烃发生的消去反应,反应③为环己烯的加成反应,B为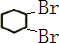 ,反应④为卤代烃的消去反应,生成环己二烯,
,反应④为卤代烃的消去反应,生成环己二烯,
(1)由以上分析可知A为 ,名称为环己烷,故答案为:
,名称为环己烷,故答案为: ;环己烷;
;环己烷;
(2)反应①为取代反应,③为加成反应,故答案为:取代反应;加成反应;
(3)反应④为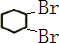 的消去反应,反应的化学方程式为
的消去反应,反应的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的合成与推断,为高考常见题型,明确反应条件与反应类型的关系来推出各物质是解答本题的关键,注意卤代烃的水解、消去反应的条件,题目难度不大.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素②与元素③处于同一周期 | |
| B. | 元素④的原子序数小于元素⑦的 | |
| C. | 元素⑧的还原性比元素⑥的强 | |
| D. | 元素⑤的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,1L0.1mol/L的Na2CO3溶液中含有CO32-和HCO3-离子数之和为0.1NA | |
| B. | 标准状况下,11.2L丙烷中含有的极性共价键数目为4NA | |
| C. | 向Fel2溶液中通入适量Cl2,当有1molFe2+被氧化时,共转移的电子数目为NA | |
| D. | 标准状况下,22.4LCl2与足量NaOH溶液反应,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
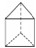 .
.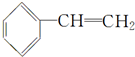 ,写出其发生加聚反应的化学方程式:
,写出其发生加聚反应的化学方程式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
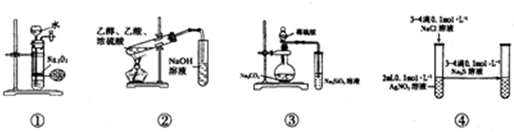
| A. | 装置①可制备少量氧气 | |
| B. | 装置②可用于实验室制取和收集乙酸乙酯 | |
| C. | 装置③的实验可推断硫、碳、硅三种元素的非金属强弱 | |
| D. | 装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D 形成的简单离子半径依次增大 | |
| B. | B、C 形成的化合物只含有离子键 | |
| C. | A、C、D 形成的化合物CDA4,属于离子化合物,有较强的还原性 | |
| D. | A、B、C 形成的化合物与B、C、D 形成的化合物可以发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水替代水与电石反应,可以减缓乙炔的产生速率 | |
| B. | 配制一定物质的量浓度的溶液定容时,俯视刻度线会使浓度偏低 | |
| C. | 测定中和反应的反应热时,将碱缓慢倒入酸中,不影响测定结果 | |
| D. | 用NaOH标准液滴定待测浓度盐酸,达终点时滴定管尖嘴有悬滴,则测定结果偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
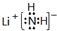 .
.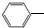 CH2CH3(g)?催化剂
CH2CH3(g)?催化剂 CH=CH2(g)+H2(g)
CH=CH2(g)+H2(g)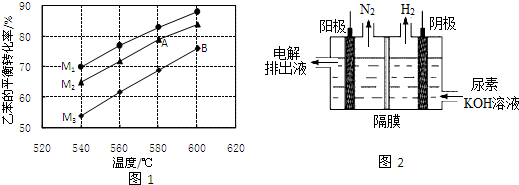
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黏土 | B. | 纯碱、石灰石、石英砂 | ||
| C. | 黏土、石灰石 | D. | 二氧化硅、硅酸钙、硅酸铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com