
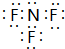 ,
,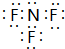 ;
;
| ||
| ||


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
| A、标准状况下,1molH2O的体积约为22.4L |
| B、1L1mol/L的CaCl2溶液中含Cl-的数目为NA |
| C、在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA |
| D、标准状况下,2.24 LCl2做成的氯水中含有0.1NA个Cl2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下11.2 L CCl4和0.5NA个NO2 分子个数相同 |
| B、1 mol NH3和22.4 L Ne的电子数相等 |
| C、4℃时,36 mL 水和2×105Pa,27℃时32 g O2氧原子数相同 |
| D、1×105Pa,0℃时22.4 L SO3和含4mol氧原子的H2SO4分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
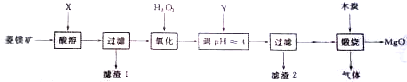
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2的水溶液能导电,所以CO2是电解质 |
| B、BaSO4不溶于水,其水溶液很难导电,所以BaSO4是非电解质 |
| C、液氯不导电,所以液氯是非电解质 |
| D、氯化氢的水溶液能导电,所以氯化氢是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
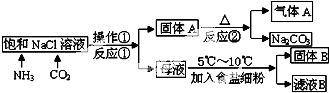
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属Cu中Cu原子堆积方式为面心立方最密堆积,每个Cu原子的配位数均为12 |
| B、晶体的熔点:SiC>CCl4>P4>SO2 |
| C、酸性:HClO4>HClO3>HClO |
| D、晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、前20 min的平均反应速率v(C)=0.1 mol/(L?min) |
| B、A的转化率为50% |
| C、C的平衡浓度c(C)=4 mol/L |
| D、B的平衡浓度c(B)=1.5 mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com