
【题目】常温下用NaOH溶液滴定H2C2O4溶液的过程中,溶液中-lg![]() 和-lg c(HC2O4-)或-lg
和-lg c(HC2O4-)或-lg![]() 和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )
和-lg c(C2O42-)的关系如图所示。下列说法正确的是( )

A.Ka1(H2C2O4)数量级为10-1
B.曲线N表示-lg![]() 和-lg c(HC2O4-)的关系
和-lg c(HC2O4-)的关系
C.向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O4-)相等,此时溶液pH约为5
D.在NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
【答案】C
【解析】
H2C2O4溶液存在H2C2O4HC2O4-+H+,HC2O4-C2O42-+H+,Ka1(H2C2O4)= ×c(HC2O4-),Ka2(H2C2O4)=
×c(HC2O4-),Ka2(H2C2O4)=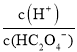 ×c(C2O42-),[-lg
×c(C2O42-),[-lg ]+[-lgc(HC2O4-)]=-lg(Ka1),[-lg
]+[-lgc(HC2O4-)]=-lg(Ka1),[-lg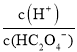 ]+[-lgc(C2O42-)]=-lg(Ka2),因Ka1>Ka2,则-lg(Ka1)<-lg(Ka2),可知曲线M表示-lg
]+[-lgc(C2O42-)]=-lg(Ka2),因Ka1>Ka2,则-lg(Ka1)<-lg(Ka2),可知曲线M表示-lg 和-lgc(HC2O4-)的关系,曲线N表示-lg
和-lgc(HC2O4-)的关系,曲线N表示-lg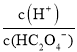 和-lgc(C2O42-)]的关系。
和-lgc(C2O42-)]的关系。
A.根据上述分析,因为-lg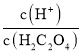 -lg c(HC2O
-lg c(HC2O![]() )=2,则Ka1(H2C2O4)=
)=2,则Ka1(H2C2O4)=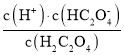 =10-2,数量级为10-2,故A错误;
=10-2,数量级为10-2,故A错误;
B.H2C2O4为弱酸,第一步电离平衡常数>第二步电离平衡常数,即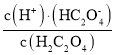 >
>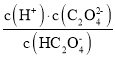 ,则lg
,则lg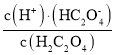 >lg
>lg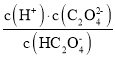 ,则-lg
,则-lg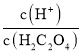 -lgc(HC2O4-)<-lg
-lgc(HC2O4-)<-lg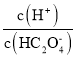 -lgc(C2O42-),因此曲线M表示-lg
-lgc(C2O42-),因此曲线M表示-lg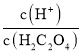 和-lg c(HC2O4-)的关系,曲线N表示-lg
和-lg c(HC2O4-)的关系,曲线N表示-lg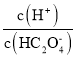 和-lgc(C2O42-)的关系,故B错误;
和-lgc(C2O42-)的关系,故B错误;
C.根据A的分析,Ka2(H2C2O4)=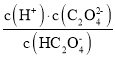 =10-5,向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,Ka2(H2C2O4)=c(H+)=10-5,此时溶液pH约为5,故C正确;
=10-5,向NaHC2O4溶液中加NaOH至c(HC2O4-)和c(C2O42-)相等,Ka2(H2C2O4)=c(H+)=10-5,此时溶液pH约为5,故C正确;
D. 根据A的分析,Ka1(H2C2O4)=10-2,则NaHC2O4的水解平衡常数![]() =10-12<Ka2(H2C2O4),说明以电离为主,溶液显酸性,但是其电离和水解程度都较小,钠离子不水解,钠离子浓度最大,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故D错误;
=10-12<Ka2(H2C2O4),说明以电离为主,溶液显酸性,但是其电离和水解程度都较小,钠离子不水解,钠离子浓度最大,则c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】钨是高熔点金属,工业上用主要成分为FeWO4和MnWO4的黑钨铁矿与纯碱共熔冶炼钨的流程如下,下列说法不正确的是( )

A.将黑钨铁矿粉碎的目的是增大反应的速率
B.共熔过程中空气的作用是氧化Fe(II)和Mn(II)
C.操作II是过滤、洗涤、干燥,H2WO4难溶于水且不稳定
D.在高温下WO3被氧化成W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
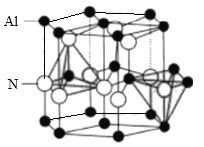
【题目】氮化铝(AlN)陶瓷是一种新型无机非金属材料, 最高可稳定到2473K, 导热性好、热膨胀系数小,是良好的耐热冲击材料。制取原理为:Al2O3+3C+N2![]() 2A1N+3CO,回答下列问题:
2A1N+3CO,回答下列问题:
(1)氮化铝的晶体类型为________。在上述化学方程式中第二周期元素的第一电离能由小到大的顺序是______。
(2)基态氧原子电子占据最高能级的原子轨道的形状是________,未成对电子数为________。
(3)等电子体具有相似的结构。CO与N2互为等电子体,CO分子中σ键与π键数目之比为_______。
(4)Cu2+处于:[Cu(NH3)4]2+的中心,若将配离子[Cu(NH3)4]2+中的2个NH3换为CN-,则有2种结构,则Cu2+是否为sp3杂化________(填“是”或“否”)理由为_________。
(5)AlN晶体结构如图所示,1个Al原子周围距离最近的Al原子数为______个;若晶胞结构的高为a nm, 底边长为b nm,NA表示阿伏伽德罗常数的值,则其密度为_______g.cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱 | 电离常数(Ka或Kb) |
CH3COOH | Ka=1.75×10-5 |
柠檬酸(H3C6H5O7) | Ka1=7.4×10-4 Ka2=1.73×10-5 Ka3=4.0×10-7 |
NH3·H2O | Kb=1.75×10-5 |
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.![]()
B.c(H+)
C.c(OH-)·c(H+)
D.![]()
E.![]()
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微量元素硼对植物的生长和人体骨骼的健康有着十分重要的作用。请回答下列问題:
(1)区分晶体硼和无定硼形科学的方法为_________________________________。
(2)下列B原子基态的价层电子排布图中正确的是___________
A.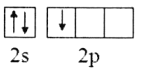 B.
B.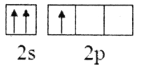
C.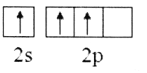 D.
D.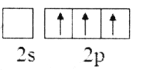
(3)NaBH4是重要的储氢载体,阴离子的立体构型为___________。
(4)三硫化四磷分子(结构如下图1所示)是___________分子(填极性”或非极性)。
(5)图2表示多硼酸根离子的一种无限长的链式结构,其化学式可表示为___________。
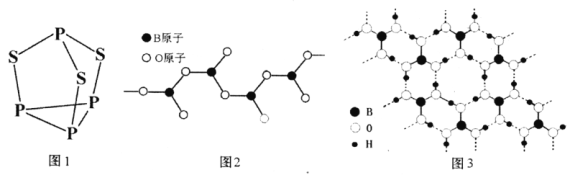
(6)硼酸晶体是片层结构,其中一层的结构如图3所示。硼酸在冷水中溶解度很小,但在热水中较大,原因是_________________________________。
(7)立方氮化硼(BN)是新型高强度耐磨材料,可作为金属表面的保护层,其晶胞结构(如右图)与金刚石类似。已知该晶体密度为ag/cm3,则晶体中两个N原子间的最小距离为___________pm。(用含a的代数式表示,NA表示阿伏加德罗常数)
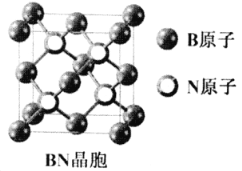
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如下:
实验编号 | c(HA)/ mol·L-1 | c(NaOH)/ mol·L-1 | 反应后溶液pH |
甲 | 0.1 | 0.1 | pH=9 |
乙 | c1 | 0.2 | pH=7 |
下列判断不正确的是
A.c1一定大于0.2 mol·L-1
B.HA的电离方程式是HA![]() H++A-
H++A-
C.甲反应后溶液中:c(Na+) > c(OH-)> c(A-) > c(H+)
D.乙反应后溶液中:c(Na+) < c(HA)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有酚类物质的废水来源广泛,危害较大。含酚废水不经处理排入水体,会危害水生生物的繁殖和生存;饮用水含酚,会影响人体健康。某科研结构研究出一种高效光催化剂BMO(Bi2MoO6),可用于光催化降解丁基酚,原理如图所示。下列说法错误的是( )
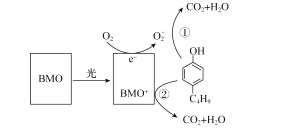
A.光催化剂BMO可降低丁基酚氧化反应的ΔH
B.在丁基酚氧化过程中BMO表现出强还原性
C.苯环上连有一OH和一C4H9的同分异构体共有12种(不考虑立体异构)
D.反应中BMO参与反应过程且可以循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,浓度均为0.1mol/L的溶液,其pH如下表所示。有关说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaF | CH3COONa |
pH | 7.0 | 7.0 | 8.1 | 8.9 |
A.酸性强弱:CH3COOH>HF
B.离子的总浓度:①>③
C.②中:c(CH3COO-)=c(NH4+)=c(OH-)=c(H+)
D.②和④中c(CH3COO-)相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com