
| A. | 纸上层析法通常以滤纸作为惰性支持物.滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 | |
| B. | 重结晶时,溶质的溶解度越大、溶液冷却速度越慢,得到的晶体颗粒越大 | |
| C. | 制备硫酸亚铁铵晶体需要将饱和硫酸铵溶液与新制硫酸亚铁溶液混合,加热蒸发,趁热过滤 | |
| D. | 在牙膏的浸泡液中加入新制碱性Cu(OH)2,溶液变绛蓝色 |
分析 A.纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,常用滤纸作载体,滤纸上所吸收的水分作固定相,有机溶剂作流动相;
B.冷却速度慢,则易析出晶体,越慢晶体析出越大;
C.硫酸亚铁铵溶解度较小,所以通过蒸发浓缩可以得到硫酸亚铁铵晶体,不能蒸干,否则会失去结晶水;
D.多羟基的物质与Cu(OH)2生成配合物,得到绛蓝色溶液.
解答 解:A.纸上层析是利用混合物中各组分在固定相和流动相中的溶解度不同而达到分离目的,常用滤纸作载体,滤纸上所吸收的水分作固定相,有机溶剂作流动相,当流动相流过固定相时,各组分以不同的速度移动,从而使混合物分离,故A正确;
B.重结晶时,冷却速度慢时,可使溶液的过饱和度缓慢释放,使晶体有充足的时间生长,所以得到的晶体颗粒越大,故B正确;
C.相同温度下硫酸亚铁铵晶体在水中的溶解度比硫酸亚铁和硫酸铵的溶解度小,所以将硫酸亚铁和硫酸铵的混合溶液加热浓缩就能得到硫酸亚铁铵晶体,当出现晶膜时停止加热,然后让其自然冷却,不能蒸干,否则会失去结晶水;晶体析出后抽滤,并用少量乙醇洗涤即可获得硫酸亚铁铵,故C错误;
D.牙膏中含有甘油,多羟基的物质与Cu(OH)2生成配合物,得到绛蓝色溶液,故D正确.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、物质的检验及制备等,侧重物质性质及实验技能的考查,注意实验的评价性、操作性分析,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Na+、Fe2+、NO3-、Cl- | |
| B. | pH=7的溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| C. | 使酚酞变红的溶液中:Ba2+、Cl-、Na+、NO3- | |
| D. | 加入铝粉产生氢气的溶液:Na+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
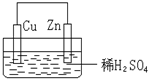
| A. | 铜片为负极 | B. | 锌片为负极 | ||
| C. | 电子通过导线由铜片流向锌片 | D. | 铜片上没有有H2逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com