
| A. | 水晶和干冰的熔化 | B. | 食盐和醋酸钠的熔化 | ||
| C. | 液溴和液汞的汽化 | D. | 氨的气化和水的电离 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6和C3H8 | B. | C4H6和C3H8 | C. | C5H12和C6H6 | D. | C3H6和C3H8O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向FeCl3中滴入KSCN,出现红色 | |
| B. | 向Cu与Cl2反应后的集气瓶中加少量H2O,呈绿色,再加水,呈蓝色 | |
| C. | Cu与浓硝酸反应后,溶液呈绿色;Cu与稀硝酸反应后,溶液呈蓝色 | |
| D. | 向AlCl3中逐滴滴加NaOH至过量,先出现白色沉淀,继而消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④⑤ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

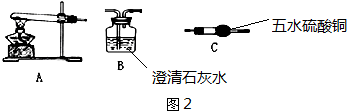

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
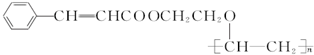 .按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.
.按如图所示关系可以合成甲,其中试剂I可由乙醇与氧气在催化剂加热条件下反应得到.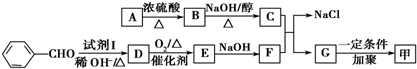
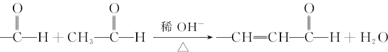
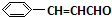 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2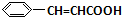 +H2O;
+H2O;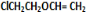 +
+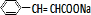 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$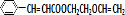 +NaCl.
+NaCl.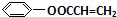 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com