
在如下图所示的物质转化关系中,A是一种固体单质,E是一种白色不溶物,请完成下列问题:

(1)B的化学式为___________,目前B已被用作_____________________的主要原料。
(2)B和a溶液反应的离子方程式:________________________________________________。
(3)A和a溶液反应的离子方程式:_____________________________________________。
(4)C和过量盐酸反应的离子方程式:___________________________________________。
(1)SiO2 光导纤维
(2)SiO2+2OH-====![]() +H2O
+H2O
(3)Si+2OH-+H2O====![]() +2H2↑
+2H2↑
(4) ![]() +2H+====H2SiO3↓
+2H+====H2SiO3↓
根据题给信息和框图,B是A的氧化物,能与同一种溶液反应的单质和其氧化物只有Si和SiO2,a溶液是强碱(如NaOH)溶液或HF溶液,而Si和SiO2与NaOH溶液反应均生成Na2SiO3。Na2SiO3与过量盐酸反应生成NaCl和H2SiO3白色沉淀:H2SiO3![]() SiO2+H2O,与题意相符。Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应。因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH)
SiO2+H2O,与题意相符。Si和SiO2与HF溶液反应均生成SiF4,SiF4与盐酸不反应。因此A是Si,B是SiO2,C是Na2SiO3(或K2SiO3),D是H2O,E是H2SiO3,F是H2,a是NaOH(或KOH)


科目:高中化学 来源: 题型:
| 3273K |
| 723~773K |
| 1373~1453K |

| 553~573K |
| 1373K |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 试验序号 | 实验步骤 | 实验现象 | 结论 |
| ① | 取少量该焰火原料, 加入冷水 |
无明显现象 | 合金中不含Li、Na等活泼金属 合金中不含Li、Na等活泼金属 |
| ② | 取少量该焰火原料, 加入足量稀盐酸 |
完全溶解,有大量气体 产生、溶液呈无色 |
含有能与盐酸反应的较活泼的金属 含有能与盐酸反应的较活泼的金属 |



查看答案和解析>>
科目:高中化学 来源: 题型:
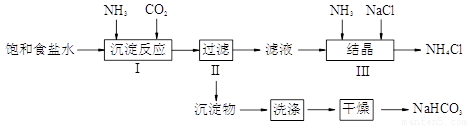
实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下:
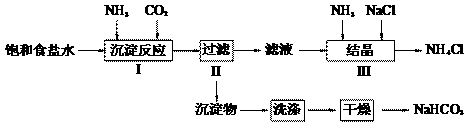
请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)
(2)写出步骤I中发生的化学反应方程式
_______________________________________________________。
若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。

(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①此处通入氨气的![]() 作用是_________。
作用是_________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
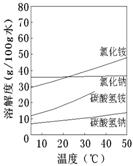
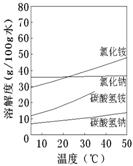
②已知四种相关物质不同温度下的溶解度曲线如图所示。结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。
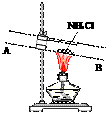
具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等[来源:学科网ZXXK]
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
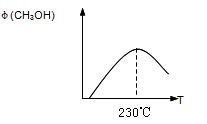
(1)合成甲醇的反应为:
CO(g)+2H2(g)![]() CH3OH(g);△H
CH3OH(g);△H
下图表示某次合成实验过程中甲醇的体积分数 φ(CH3OH)与反应温度的关系曲线,若在230℃时,平衡常数K=1。若其它条件不变,将温度升高到500℃时,达到平衡时,K 1 (填“>、< 或 = ”)
(2)利用甲醇燃料电池设计如下图所示的装置:则该装置中Cu极为 极;写出b极的电极反应式 ,当铜片的质量变化为12.8 g时:a极上消耗的O2在标准状况下的体积为 L。 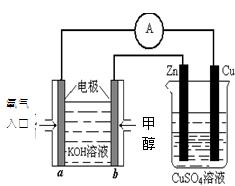
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
(3)工业中常将BaSO4转化为BaCO3后,再将其制成各种可溶性的钡盐(如:BaCl2)。
具体做法是用饱和纯碱溶液浸泡BaSO4粉末,并不断补充纯碱,最后BaSO4转化为BaCO3。现有足量BaSO4悬浊液,在该悬浊液中加纯碱粉末并不断搅拌,为使SO42-物质的量浓度达到0.0lmol·L-1以上,则溶液中CO32-物质的量浓度应≥ mol·L-1
查看答案和解析>>
科目:高中化学 来源:2010年上海市虹口区高三第二次模拟考试化学试题 题型:实验题
实验室欲制取少量NaHCO3与NH4Cl。实验步骤如下:
请回答:
(1)步骤I、III中需用到氨气,下列装置可用于实验室制氨气的是_________。(填序号)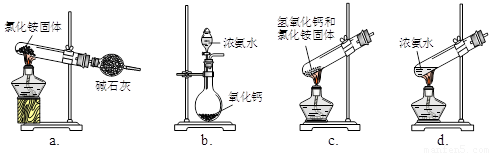
(2)写出步骤I中发生的化学反应方程式
_______________________________________________________。
若用右图装置进行该沉淀反应。实验时,须先从_____(填“a”、“b”或“c”)管通入_____气体。

(3)步骤III向滤液中通入氨气,加入细小食盐颗粒,可使NH4Cl晶体单独结晶析出。
①此处通入氨气的作用是_________。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
②已知四种相关物质不同温度下的溶解度曲线如图所示。结晶时宜采用___________(填“蒸发结晶”或“降温结晶”)。
③有人设计了如下图所示的装置来验证所得的晶体中含有NH4+。

具体操作:取少量晶体于硬质试管,对晶体部位加热。并在_____
(填“A”或“B”)处放置______________试纸,观察现象。
(4)请按提示完成NaHCO3含量分析的实验设计。
试剂:盐酸、澄清石灰水、氢氧化钡溶液、蒸馏水;
仪器:电子天平、烧杯、漏斗、玻璃棒、干燥器等[来源:ZXXK]
① _________________溶于水,加入__________________________。
②过滤、洗涤、烘干,冷却、称量,并进行_____________操作(写操作名称)。
③计算。若数据处理时将所得固体质量1.977 g错看为1.971 g,由此产生的相对误差为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com