
【题目】如图是一个石墨作电极,电解稀的Na2SO4溶液的装置,通电后在石墨电极A和B附近分别滴加一滴石蕊溶液.下列有关叙述正确的是( ) 
A.逸出气体的体积,A电极的小于B电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.A电极附近呈红色,B电极附近呈蓝色
D.电解一段时间后,将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性
【答案】D
【解析】解:如图是一个石墨作电极,石墨作电极,电解稀的Na2SO4溶液实质就是电解水, A、A电极是阴极产生氢气,B电极是阳极产生氧气,两者的体积之比为2:1,所以逸出气体的体积,A电极的大于B电极的,故A错误;
B、氧气和氢气都是无色无味的气体,不可能逸出刺激性气味气体,故B错误;
C、A电极是阴极产生氢气,产生氢氧根离子,呈碱性石蕊溶液呈蓝色,而B电极是阳极产生氧气,同时产生氢离子,所以B极区呈酸性石蕊溶液呈红色,故C错误;
D、石墨作电极,电解稀的Na2SO4溶液实质就是电解水,所以电解后的溶液呈中性,所以将全部电解液转移到同一烧杯中,充分搅拌后溶解呈中性,故D正确;
故选D.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g)+CO(g)CH3OH(g)
(1)如表所列数据是该反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①该反应的熵变△S0 ( 填:“<,>,=”).该反应在(填:高温或低温)条件下能自发进行.
②要提高CO的转化率,可以采取的措施是(填序号).
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率AC(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数AC,由状态B到状态A,可采用的方法(填“升温”或“降温”). 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电﹣Fenton法是用于水体里有机污染物降解的高级氧化技术,其反应原理如图所示,其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH﹣+OH,生成的烃基自由基(OH)能氧化降解有机污染物.下列说法不正确的是( ) 
A.电源的A极是负极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O﹣e﹣=OH+H+ ,
D.消耗1molO2 , 可以产生4molOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物含有C、H、O、N四种元素,下图是该有机物的球棍模型:
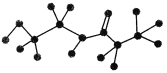
(1)该有机物的分子式为________,结构简式为__________________。
(2)该有机物可能发生的反应有________(填编号)。
①取代反应 ②消去反应 ③加聚反应 ④氧化反应 ⑤酯化反应 ⑥缩聚反应
(3)该有机物发生水解反应的化学方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NH4+、NH3、NH2﹣三种微粒的说法不正确的是( )
A.三种微粒所含有的电子数相等
B.三种微粒中氮原子的杂化方式相同
C.三种微粒的空间构型相同
D.键角大小关系:NH4+>NH3>NH2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】COCl2的分解反应为COCl2(g)Cl2(g)+CO(g).将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的量在不同条件下的变化情况如图所示.下列相关说法中不正确的是( ) 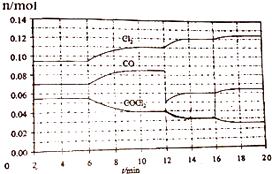
A.1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B.若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C.12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D.以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I﹣等)中回收碘,其实验过程如图1: 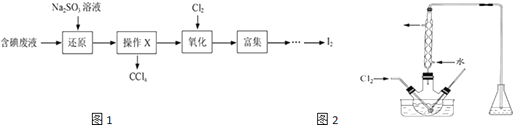
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I﹣ , 其离子方程式为该操作将I2还原为I﹣的目的是 .
(2)操作X的名称为 .
(3)氧化时,在三颈瓶中将含I﹣的水溶液用盐酸调至pH约为2,缓慢通入Cl2 , 在400C左右反应(实验装置如图2所示).实验控制在较低温度下进行的原因是;锥形瓶里盛放溶液作用的为 .
(4)已知:5SO32﹣+2IO3﹣+2H+═I2+5SO42﹣+H2O 某含碘废水(pH约为8)中一定存在I2 , 可能存在I﹣、IO3﹣中的一种或两种.请补充完整检验含碘废水中是否含有I﹣、IO3﹣的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;证明废水中含有I﹣的方法是;证明废水中含有IO3﹣的方法是 . (实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)pH=2的某酸稀释100倍,pH________4,pH=12的某碱稀释100倍,pH________10。
(2)室温时,将pH=5的H2SO4溶液稀释10倍,c(H+)∶c(SO42-)=________,将稀释后的溶液再稀释100倍,c(H+)∶c(SO42-)=________。
(3)
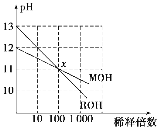
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如上图所示。下列叙述中不正确的是( )
A.MOH是一种弱碱
B.在x点,MOH完全电离
C.在x点,c(M+)=c(R+)
D.稀释前ROH溶液中c(OH-)是MOH溶液中c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置是化学实验中常见的仪器,它除用于洗气外,还有其它用途.
(1)医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装盛有水的该装置,用于观察气泡产生的情况,以便调节供氧速率,此时氧气应从(填标号,下同)管口导入.
(2)实验室用MnO2与浓HCl反应制Cl2的实验中,在将生成的Cl2通入NaOH溶液之前,先将Cl2从该装置管口导进,从管口导出,此时,该装置所起的作用是防止NaOH溶液倒流入反应器.
(3)当用此装置收集NO时,应采取的主要操作步骤是:①;② .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com