
| A. | 与酸反应产生氢气多 | B. | 与碱反应产生氢气多 | ||
| C. | 一样多 | D. | 不知道铝粉的质量,无法比较 |
科目:高中化学 来源: 题型:解答题
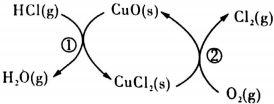
| t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
| N(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3属于弱电解质 | |
| B. | 可用湿润的红色石蕊试纸检验氨气 | |
| C. | 用盐酸滴定氨水,当溶液呈中性时,c(NH4+)=c(Cl-) | |
| D. | 常温时,0.1mol•L-1NH4Cl溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$的值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )
某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(ml)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( )| A. | 该未知溶液中至少含有3种阳离子 | |
| B. | 滴加的NaOH溶液的物质的量浓度为5mol•L-1 | |
| C. | 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g | |
| D. | 若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.01 mol•L-1•s-1 | B. | v(NH3)=0.02mol•L-1•s-1 | ||
| C. | v(H2O)=0.06 mol•L-1•min-1 | D. | v(NO)=0.03mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com