
| A. | NH3 | B. | 蔗糖 | C. | 空气 | D. | 液态HC1 |
分析 水溶液能导电,说明溶液中含有离子,在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质,无论电解质还是非电解质,都一定为化合物,据此进行判断.
解答 解:A.NH3溶于水得到的溶液叫做氨水,其中含有铵根离子、氢氧根离子,能够导电,但该离子来源于一水合氨的电离,所以一水合氨是电解质,NH3是非电解质,故A正确;
B.蔗糖溶于水不能发生电离,仍以分子形式存在,因此蔗糖溶液不导电,蔗糖是非电解质,故B错误;
C.空气是混合物,既不是电解质也不是非电解质,故C错误;
D.液态HC1溶于水时发生电离,因此水溶液能够导电,是电解质,故D错误;
故选A.
点评 本题考查水溶液导电的原因、电解质和非电解质的区别,题目难度不大,明确电解质和非电解质的区别、水溶液导电的原因是关键.


科目:高中化学 来源: 题型:解答题
 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V甲=V乙>V丙 | B. | V丙>V乙>V甲 | C. | V乙>V丙>V甲 | D. | V甲=V乙=V丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 810℃ | 54.0% | a | b |
| 915℃ | c | 75.0% | d |
| 1000℃ | e | f | 83.0% |
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
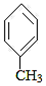 +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$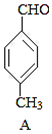 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$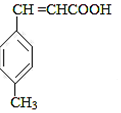 $→_{浓硫酸,△}^{CH_{3}OH}$E
$→_{浓硫酸,△}^{CH_{3}OH}$E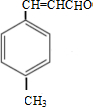 ,生成E的反应类型为酯化反应或取代反应
,生成E的反应类型为酯化反应或取代反应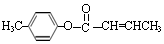 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为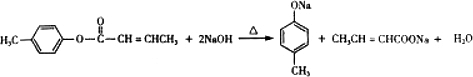 .
.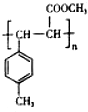 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
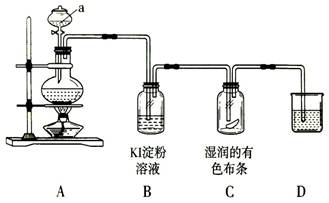
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com