
【题目】下列说法中正确的是( )
A. 铊与铝同主族,氧化铝是两性氧化物,所以铊的氧化物也是两性氧化物
B. 第三周期简单离子的半径从左到右依次减小
C. 在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
D. 用电子式表示HCl的形成过程![]()
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.同分异构体由于结构不同,所以化学性质一定不相似
B.同系物一定同类,且电子数之差一定为8的整数倍
C.凡是分子组成相差一个或几个CH2原子团的物质,彼此一定是同系物
D.两种化合物组成元素相同,各元素质量分数也相同,则两者一定是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种有机物的结构简式如图,关于它的性质不正确的说法是( )
A.它有酸性,1 mol该物质最多能与6 mol H2发生加成反应
B.它可以水解,水解产物为两种有机物
C.在一定条件下,1 mol该物质最多能和8 mol NaOH反应
D.该有机物能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9×10﹣3mol/L.表示该体检指标的物理量是( )
A.溶解度(s)
B.物质的量浓度(c)
C.质量分数(w)
D.摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究大气中含硫化合物(主要是H2S和SO2)的转化具有重要意义。
(1)H2S资源化利用途径之一是回收能量并得到单质硫,如图为质子膜H2S燃料电池的示意图。
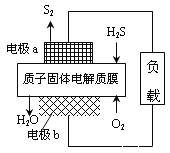
①电极a为电池的_______极,电极b上发生的电极反应为:______________________。
②每17gH2S参与反应,有_____molH+经质子膜进入_____极区。
(2)低浓度SO2废气的处理是工业难题,目前常用的方法如下:
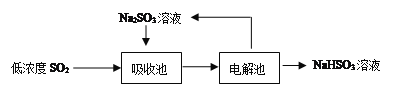
①Na2SO3溶液吸收SO2的化学方程式是____________________________________。
②如果用含等物质的量溶质的下列各溶液分别吸收SO2,则理论吸收量最多的是(____)
A.Na2SO3B.Na2S C.Ba(NO3)2 D.酸性KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知温度T时水的离子积常数为KW , 该温度下,将浓度为a mol/L的一元酸HA与b mol/L一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A.混合溶液的pH=7
B.混合溶液中,c(H+)= ![]() mol/L
mol/L
C.a=b
D.混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)2C(g)△H=a kJmol﹣1 . (a>0),实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是( )
容器 | 起始时各物质的物质的量/mol | 达到平衡时 | ||
A | B | C | ||
① | 1 | 2 | 0 | 吸收热量:0.25akJ |
② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
A.容器①、②中反应的平衡常数相等
B.平衡时,两个容器中C的体积分数均约为18%
C.容器②中达到平衡时吸收的热量Q=0.25a kJ
D.若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子垃圾中含有大量的废弃塑料和重金属,工业上可以从电子废料(电脑主板和手机废件)中提取大量的金、银和铜,每吨电子废料中能够提取出130公斤铜,0.45公斤黄金和2公斤白银,提取流程如下:

请回答下列问题:
(1)“酸溶”过程中,王水与金反应的化学方程式为________________________。
(2)“萃取”过程中,将混合液分离所需要的主要仪器为____________________,该仪器在使用前必须进行的操作为____________________________。
(3)“还原Ⅰ”制备单质Ag的过程中,发生反应的本质是Zn和AgCl在电解质HCl中形成微电池,该过程的总反应为:2AgCl+Zn=2Ag+ZnCl2,则该电池正极的电极反应式为__________________________。
(4)滤渣的主要成分为Cu2(OH)2CO3,则“沉铜”过程中发生反应的离子方程式为______________________。
(5)滤液为NaCl、Na2CO3和NaHCO3的混合液,若上述三种物质的物质的量浓度相同,则溶液中各离子浓度的大小顺序为______________________。
(6)根据下表中数据,综合分析工业上进行“还原Ⅱ”过程中所选用的还原剂最好为______________。
物质 | 价格(元·吨-1) |
双氧水(含30%H2O2) | 3200 |
绿矾(含99.0%FeSO4·7H2O) | 1800 |
亚硫酸氢钠(含99.5%NaHSO3) | 2850 |
草酸(含99.0%H2C2O4) | 3000 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com