
分析 先将物质的按照碱、盐、酸的顺序分类,再根据盐的水解和弱电解质的电离特点比较pH,再按照溶液的pH由大到小进行排序.
解答 解:属于碱的为:④Ba(OH)2 ,⑤NaOH,⑨NH3.H2O,浓度相同时,碱性及pH为④>⑤>⑨;
水解呈碱性的为:⑥CH3COONa,⑩NaHCO3 依据水解程度大小分析,则pH:⑩>⑥;
溶液呈中性的为:⑦KCl;
溶液呈酸性的有:①②③⑧,其中⑧NH4Cl溶液中铵根离子水解显酸性,①为一元强酸,②为二元强酸,③为一元弱酸,故当浓度相同时,溶液的pH:⑧>③>①>②,
综合以上分析可知,溶液的pH由小到大的顺序是为:②①③⑧⑦⑥⑩⑨⑤④,
故答案为:②①③⑧⑦⑥⑩⑨⑤④.
点评 本题考查了溶液pH的大小比较,题目难度不大,注意考虑电解质的强弱以及盐类的水解情况,试题侧重对学生基础知识的训练和检验,有利于培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O═NH4++OH- | B. | H2S?S2-+2H+ | ||
| C. | CaCO3?Ca2++CO32- | D. | CH3COONH4═CH3COO-+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷在空气中燃烧 | B. | 金属钠与水反应 | ||
| C. | 铝粉与氧化铁粉末反应 | D. | 焦炭在高温下与水蒸气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
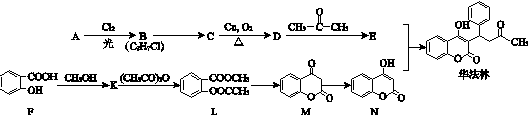
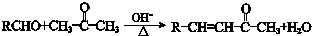
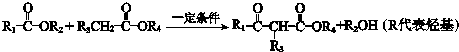
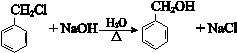 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:
如图是周期表中原子序数小于20的9种元素单质的沸点与原子序数的关系,图中原子序数是连续的.试根据如图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 0.1032mol/LHCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 25.53 | 25.00 |
| 3 | 27.85 | 25.00 |
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com