
【题目】把3.9gNa2O2放入100mL水中,充分反应后,计算:
(1)生成O2的体积(标准状况);
(2)反应后所得NaOH的物质的量浓度(反应前后溶液体积变化忽略不计).
【答案】(1)生成标准状况下氧气的体积为0.56L;
(2)所得溶液中溶质的物质的量浓度为1mol/L.
【解析】
试题分析:(1)n(Na2O2)=![]() =0.05mol,过氧化钠和水反应生成氢氧化钠和氧气,根据过氧化钠和氧气之间的关系式计算氧气体积;
=0.05mol,过氧化钠和水反应生成氢氧化钠和氧气,根据过氧化钠和氧气之间的关系式计算氧气体积;
(2)根据钠原子守恒计算NaOH的物质的量,再根据c=![]() 计算溶液浓度.
计算溶液浓度.
解:(1)过氧化钠的物质的量为:n(Na2O2)=![]() =0.05mol,
=0.05mol,
过氧化钠和水反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O=4Na++4OH﹣+O2↑,据此可得关系式2Na2O2﹣﹣﹣﹣O2,
所以生成的氧气在标准状况下的体积为:![]() ×22.4L/mol=0.56L,
×22.4L/mol=0.56L,
答:生成标准状况下氧气的体积为0.56L;
(2)根据钠原子守恒得n(NaOH)=2n(Na2O2)=2×0.05mol=0.1mol,c(NaOH)=![]() =1mol/L,
=1mol/L,
答:所得溶液中溶质的物质的量浓度为1mol/L.


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是
A. 1mol乙烯分子中含有共用电子对数为6NA
B. 常温常压下,32gO2、O3的混合物含有Na个氧原子
C. 标准状况下,2.24 L CH2Cl2含有的分子数等于0.1 NA
D. 7.1 g C12与足量NaOH溶液反应转移0.2×6.02×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔬菜、水果中富含纤维素,纤维素被食入人体后的作用是
A. 为人体内的化学反应提供原料
B. 为维持人体生命活动提供能量
C. 加强胃肠蠕动,具有通便功能
D. 人体中没有水解纤维素的酶,所以纤维素在人体中没有任何作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为元素周期表中短周期元素,其原子序数依次递增.请结合下表信息回答问题:

(1)元素B和E形成的化合物的电子式为 ,该化合物含有 (填“离子键”或“共价键”).
(2)B的单质在A的单质中燃烧的化学方程式为
(3)元素D、E的最高价氧化物对应的水化物的酸性 大于 (填化学式).
(4)请举出C单质的一种用途 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟企业对含铬废水(Cr2O72-和Cr3+)处理流程如下。
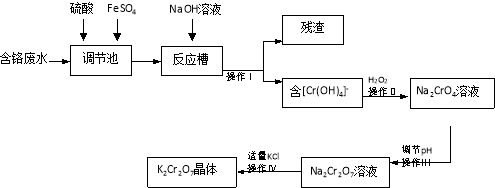
已知:2CrO42-+2H+=Cr2O72-+H2O
请回答:
(1)用离子方程式表示调节池里发生的反应: 。
(2)操作Ⅰ得到的残渣的化学式为 。
(3)操作Ⅲ调节pH时最适合作为调节剂的是
A.4mol·L-1盐酸 B.6mol·L-1硫酸
C.石灰乳 D.碳酸钠
(4)为检测处理后废水中铬的含量,取100mL处理后的样品于锥形瓶中,用浓醋酸调节pH=5,并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr3+,再用amol·L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr2O72-→2Cr3+,Cr3++Y4-=CrY-
①滴定时采用右图所示的侧边自动定零位滴定管,具有的优点 。
②实验消耗EDTA标准溶液b mL,则处理后废液中含铬浓度为 mg·L-1(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修3:物质结构与性质】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布图为___________。
(2)锗、砷、硒的第一电离能大小排序为_____________。(用元素符号表示)
(3)SeO32-的中心原子杂化类型是___________;SeO32-的立体构型是_____________;与SeO32-互为等电体的分子有(写一种物质的化学式即可)_____________。
(4)H2Se属于___________(填:极性或非极性)分子;比较H2O、H2Se的沸点高低:H2O_________H2Se(填“>”“<”或“=”),其原因是_____________。单质硒的熔点为217℃ ,它属于____________晶体。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为_________;若该晶胞密度为pg·cm-3,硒化锌的摩尔质量为Mg/mol。NA代表阿伏加德罗常数,则晶胞参数a为_______pm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数:X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子数与p电子数之比为1:1,Y原子最外层s电子数之比为1:1,Z原子的p电子数比Y原子的多2个.
(1)四种元素原子半径从大到小的顺序为 (用元素符号表示).
(2)请用“>”或“<”填空:
第一电离能 | 电负性 | 氢化物沸点 | 最高价氧化物对应水化物的碱性 |
W X | Z Y | Y Z | W X |
(3)写出X元素的单质与Z、Y所形成的化合物反应的化学方程式,并标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用O2将HC1转化为Cl2,可提高效益,减少污染,传统上该转化通过如下图所示的催化剂循环实现,

其中,反应①为:2HCl(g)+CuO(s) ![]() H2O(g)+CuCl2(s) △H1,反应②生成1 mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为____________________________。(反应热用△H1和△H2表示)。
H2O(g)+CuCl2(s) △H1,反应②生成1 mol Cl2 (g)的反应热为△H2,则总反应的热化学方程式为____________________________。(反应热用△H1和△H2表示)。
(2)一定条件下测得上述反应过程中c(Cl2)的数据如下:
t(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3(mol/L) | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的物质的量浓度变化表示的反应速率 _________。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

0~tl时,原电池的负极是Al片,此时,正极的电极反应式是______________,溶液中的H+向______极移动,tl时,原电池中电子流动方向发生改变,其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com