
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 用湿润的碘化钾淀粉试纸鉴别Br2(g)和NO2 | |
| C. | 在50mL量筒中配制0.1000mol•L-1碳酸钠溶液 | |
| D. | 检验NH4+时,向试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体 |
分析 A.振荡分液漏斗时,避免液体流出;
B.Br2(g)和NO2均可氧化KI;
C.量筒中不能配制溶液;
D.检验氨气用湿润的红色石蕊试纸.
解答 解:A.使用分液漏斗进行分液操作时,振荡前应关闭其玻璃塞和活塞,避免液体流出,然后再进行振荡,故A正确;
B.Br2(g)和NO2均可氧化KI,则用湿润的碘化钾淀粉试纸不能鉴别Br2(g)和NO2,可选水鉴别,故B错误;
C.量筒中不能配制溶液,量筒只能量取液体,可在容量瓶中配制一定浓度的溶液,故C错误;
D.检验NH4+时,向试样中加入NaOH溶液,微热生成氨气,用湿润的红色石蕊试纸检验逸出的气体,若红色石蕊试纸变蓝,证明含NH4+,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质鉴别、实验基本操作、溶液配制及离子检验等,把握物质的性质、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | 晶体硅 | 高纯硅广泛用于光导纤维、太阳能电池和计算机芯片 | 硅具有半导体性能 |
| B | 氧化铝 | 制作耐高温材料 | Al2O3熔点很高 |
| C | 硫酸钡 | 医学上用做钡餐 | Ba无毒 |
| D | 明矾 | 作消毒剂 | 明矾水解产生具有吸附性的胶体粒子 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可消除对大气的污染 | |
| B. | 可节约燃料 | |
| C. | 可缓解能源危机 | |
| D. | 此题中的CH4、CH3OH、NH3等为一级能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用热碱水清除炊具上残留的油污 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | a | b | c |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
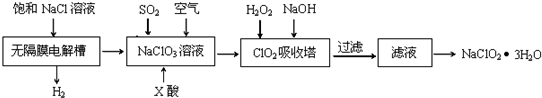

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:
X、Y、Z、W四种元素分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X和Y的氢化物都比同族下一周期元素氢化物的沸点高,但在同周期中却不是最高的.Z是同周期元素中离子半径最小的元素.W原子的价电子层上有两个运动状态不同的电子.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com