
 .
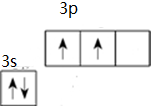
.分析 (1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图;
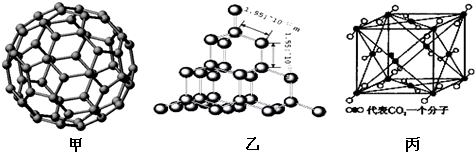
(2)原子晶体熔沸点最高,分子晶体熔沸点与分子间作用力成正比,分子间作用力与其相对分子质量成正比;
(3)二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,硅晶体中每个最小环上是6个Si原子,据此计算O原子个数;二氧化硅晶体中,每个Si原子形成Si-O键个数是4,据此计算1mol二氧化硅中Si-O键个数;
(4)1个CO2分子周围距离最近的CO2分子个数=3×8×$\frac{1}{2}$.
解答 解:(1)Si原子核外有14个电子,3s、3p电子为其价电子,根据构造原理书写其价电子排布图 ,
,
故答案为: ;
;
(2)金刚石属于原子晶体熔点最高,C60和干冰属于分子晶体,C60的相对分子质量大,范德华力强,熔点高,所以晶体熔沸点高低顺序是金刚石>C60>干冰,
故答案为:金刚石>C60>干冰;金刚石属于原子晶体熔点最高,C60和干冰属于分子晶体,C60的相对分子质量大,范德华力强,熔点高;
(3)二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子,硅晶体中每个最小环上是6个Si原子,所以Si、O原子形成的最小环上O原子的数目是6;二氧化硅晶体中,每个Si原子形成Si-O键个数是4,所以1mol二氧化硅中Si-O键个数为4NA,
故答案为:6;4NA;
(4)1个CO2分子周围距离最近的CO2分子个数=3×8×$\frac{1}{2}$=12,故答案为:12.
点评 本题考查晶胞计算、晶体熔沸点高低判断、原子核外电子排布等知识点,这些都是高频考点,侧重考查空间想象能力和计算能力,难点是配位数的计算方法,熟记金刚石、硅、二氧化硅晶体中最小环上原子个数,为易错点.


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:填空题

 ;
; (其中两种)(任意两种)
(其中两种)(任意两种)
 ,该反应的反应类型是取代反应.
,该反应的反应类型是取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4•7H2O | 30.9 | 35.5 | 40.8 | 45.6 | -- |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )的路线如下图所示:
)的路线如下图所示:
 +3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$$\stackrel{△}{→}$$\stackrel{△}{→}$ +NaCl+2H2O;
+NaCl+2H2O;  ,写出其余的同分异构体的结构简式
,写出其余的同分异构体的结构简式 、
、 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该晶体属于离子晶体 | |
| B. | 晶体的化学式为BaO2,所以晶体中阴阳离子个数比1:2 | |
| C. | 若将晶胞中阴阳离子位置互换,其图形依然可以看作该晶体的晶胞结构图 | |
| D. | 与每个Ba2+距离相等且最近的Ba2+共有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v=0.10 mol•L-1•s-1是指1 s内某物质的物质的量浓度为0.10 mol•L-1 | |
| B. | 对于任何化学反应来说,反应速率越快,反应现象就越明显 | |
| C. | 化学反应速率只是对可逆反应才适用 | |
| D. | 根据反应速率的大小,可以知道反应进行的相对快慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐、氯化钾等晶体易溶于水 | |
| B. | 氯气在加压、降温时会变成液氯或固氯 | |
| C. | 融化的铁水降温可铸成铁锭 | |
| D. | 金刚石有相当大的硬度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com