
| A. | 羟基的电子式 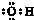 | B. | 醛基的结构简式-COH | ||
| C. | 1-丁烯的键线式  | D. | 聚丙烯的结构简式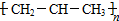 |
分析 A.羟基中含有1个氧氢键,氧原子最外层为7个电子;
B.醛基中存在碳氧双键,醛基的结构简式应该为:-CHO;
C.根据烯烃的命名原则判断;
D.聚丙烯的结构单元中,主链应该含有2个碳原子.
解答 解:A.羟基中氧原子最外层为7个电子,羟基中含有1个氧氢键,羟基正确的电子式为 ,故A错误;
,故A错误;
B.醛基为醛类的官能团,醛基的结构简式为-CHO,故B错误;
C.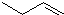 中碳碳双键位于1号C,该有机物名称为1-丁烯,故C正确;
中碳碳双键位于1号C,该有机物名称为1-丁烯,故C正确;
D.聚丙烯为丙烯通过加聚反应生成的,聚丙烯的链节中主链含有2个碳原子,聚丙烯正确的结构简式为 ,故D错误;
,故D错误;
故选C.
点评 本题考查常见化学用语的判断,为高频考点,题目难度中等,注意掌握键线式、电子式、结构简式等化学用语的概念及表示方法,试题有利于培养学生灵活应用所学知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 发生化学反应时失去电子越多的金属原子,还原能力越强 | |
| B. | 金属阳离子被还原后,一定得到该元素的单质 | |
| C. | 核外电子总数相同的原子,一定是同种元素的原子 | |
| D. | 化合反应和置换反应均属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
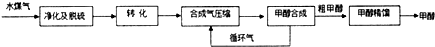
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )
把由NaOH、AlCl3、MgCl2三种固体组成的混合物溶于足量水中,有0.58g白色沉淀析出,向所得的浑浊液中,逐渐加入1mol/L盐酸,加入盐酸的体积与生成沉淀的质量关系如图所示.则混合物中NaOH质量为( )| A. | 3.6g | B. | 4g | C. | 4.4g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 增大压强 | C. | 充入N2 | D. | 降低温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com