
【题目】混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示: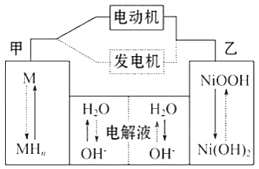
其中M为储氢合金,MH为吸附了氢原子的储氢合金,KOH溶液作电解液.关于镍氢电池,下列说法不正确的是( )
A.充电时,阴极附近pH降低
B.电动机工作时溶液中OH﹣向甲移动
C.放电时正极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣
D.电极总反应式为:M+Ni(OH)2 ![]() MH+NiOOH
MH+NiOOH
【答案】A
【解析】A.充电时阴极发生还原反应,电极反应为M+H2O+e﹣═MH+OH﹣,生成氢氧根,pH增大,故A符合题意;
B.电动机工作时是放电过程,原电池工作时,溶液中氢氧根离子向负极即甲电极迁移,故B不符合题意;
C.正极得电子发生还原反应,电极反应式为NiOOH+H2O+e﹣═Ni(OH)2+OH﹣,故C不符合题意;
D.放电过程的正极反应为NiOOH+H2O+e﹣═Ni(OH)2+OH﹣,负极反应为MH﹣e﹣+OH﹣═M+H2O,则电池总反应为M+Ni(OH)2 ![]() MH+NiOOH,故D不符合题意;
MH+NiOOH,故D不符合题意;
故答案为:A.
A.充电时阴极发生还原反应;
B.根据原电池原理判断离子移动方向;
C.根据原电池原理书写电极方程式;
D.分析工作原理书写总反应方程式.


科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X,Y,Z三种气体的物质的量随时间变化的曲线如图所示:下列描述正确的是( ) 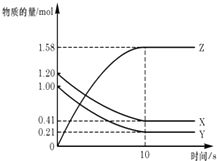
A.反应开始到10s,用Z表示的反应速率为0.158mol/(Ls)
B.反应开始到10s,X的物质的量浓度减少了0.79mol/L
C.反应开始到10s时,Y的转化率为79.0%
D.反应的化学方程式为:X(g)+Y(g)Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在AlCl3和MgCl2的混合溶液中,逐滴加入NaOH溶液直至过量,经测定,加入NaOH的体积和所得沉淀的物质的量的关系如下图所示(b处NaOH的体积为1L),则下列判断错误的是 ( )

A. NaOH的浓度为0.6 mol·L-1 B. 在a点处溶液中的溶质为NaCl
C. 混合溶液中n(Al3+)﹕n(Mg2+)=1﹕1 D. 图中线段oa : ab=4﹕1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由单质A与化合物B(固体B)两种粉末组成的混合物, 在一定条件下可按下图所示发生转化:

请回答:
(1)A的原子结构示意图是_________________,B的化学式____________________。
(2)反应②中发生的反应离子方程式_________________________________________。
(3)沉淀H→沉淀I的化学方程式___________________________________________。
(4)溶液E→沉淀J的离子方程式___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2作为一种广谱型的消毒剂,将逐渐用来取代Cl2成为自来水的消毒剂。已知ClO2是一种易溶于水而难溶于有机溶剂的气体,实验室制备ClO2的原理是用亚氯酸钠固体与氯气反应 :2NaClO2 + Cl2 ===2ClO2 + 2NaCl。
下图是实验室用于制备和收集一定量较纯净的ClO2的装置(某些夹持装置和垫持用品省略)。其中E中盛有CCl4液体(用于除去ClO2中的未反应的Cl2)。
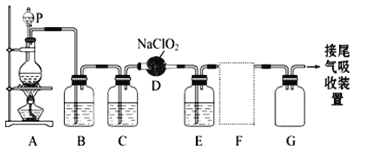
(1)仪器P的名称是_________________。
(2)写出装置A中烧瓶内发生反应的离子方程式:______________________________。
(3)B装置中所盛试剂是____________________。
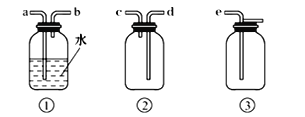
(4)F为ClO2收集装置,应选用的装置是___________(填序号),其中与E装置导管相连的导管口是__________(填接口字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)请写出Fe与水蒸气反应的化学方程式:_____________。
(2)在实验室中,FeCl2可用铁粉和______(填名称)反应制备。
(3)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为______。
(4)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:_________________。
(5)现有一含有FeCl2 和FeCl3的混合物样品,实验测得n(Fe):n(C1)=1:2.1,则该样品中FeCl3的物质的量分数为_________。
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)最简单的烃分子空间构型为____________________。
(2)衡量一个国家石油化工水平的标志是__________(填名称)的产量。
(3)2,4,6-三硝基甲苯(TNT)的结构简式为____________________。
(4)经催化加氢后生成异戊烷的炔烃结构简式为____________________。
(5)能用高锰酸钾溶液鉴别的是__________(填选项)
a.裂化汽油和直馏汽油 b.苯和甲苯
c.顺-2-丁烯和反-2-丁烯 d.乙醇和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 欲使1.6 g氧化铁完全被还原,需要CO的体积为672 mL
B. 直接加热CuO可以得到Cu单质
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e-
D. 工业上用电解法制铝,加入冰晶石是为了使氧化铝熔化的温度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com