
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | L层有三个未成对电子 |
| Y | L层p电子数比s电子数多两个 |
| Z | 元素的最高正价为+7价 |
| A. | z离子的结构示意图为: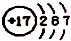 | B. | 分子TY2的键角为l80° | ||
| C. | X原子的轨道式为: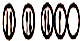 | D. | XZ3为非极性分子 |
分析 T最外层电子数是次外层电子数的2倍,则T为C,X的L层有三个未成对电子,则X为N,Y的L层p电子数比s电子数多两个,则Y为O,Z元素的最高正价为+7价,且是短周期元素,则Z为Cl,据此答题.
解答 解:T最外层电子数是次外层电子数的2倍,则T为C,X的L层有三个未成对电子,则X为N,Y的L层p电子数比s电子数多两个,则Y为O,Z元素的最高正价为+7价,且是短周期元素,则Z为Cl,
A、Z为Cl,z离子的最外层应有8个电子,故A错误;
B、CO2的分子构型为直线型,所以它的键角为l80°,故B正确;
C、X为N,在2p轨道上电子应尽可能占据不同的轨道,故C错误;
D、XZ3为NH3,分子中氮原子周围有一对孤电子对,所以氮分子是极性分子,故D错误;
故选B.
点评 此题主要考查了元素周期律以及原子核外电子排布知识,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握原子的结构特点.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | C2H6(C2H4),用镍做催化剂共热. | |
| B. | C2H4(SO2),通过盛氯水溶液洗气瓶,再用碱石灰干燥 | |
| C. | 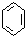 ( (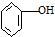 )加入过量浓溴水,先过滤;再分液 )加入过量浓溴水,先过滤;再分液 | |
| D. | C2H5Br(C2H5OH)先用大量水洗涤,然后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
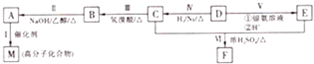
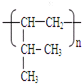
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化是一个放热的反应,所以升高温度,反应的速率减慢 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 氢氧化铝与稀硫酸反应:OHˉ+H+═H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可推知水的分解反应属于放热反应 | |
| B. | H2与O2(g)反应放出的热量称为中和热 | |
| C. | 1mol H2完全燃烧生成液态水放出的热量小于24l.8kJ | |
| D. | 断开1molH2O的化学键吸收的总能量大于断裂lmolH2和0.5molO2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
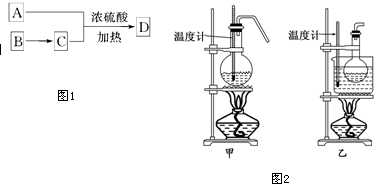
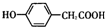 ;
; .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 :
: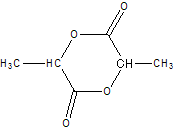 、
、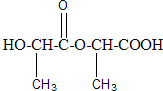 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
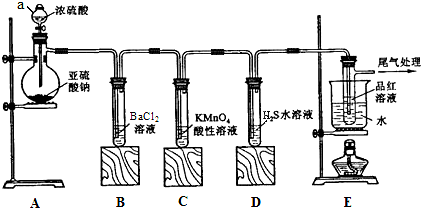
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com