
分析 常温下,水的离子积为1×10-14,向水中加入了盐酸溶液后,氢离子抑制了水的电离,溶液中的氢氧根离子是水电离的,则由水电离产生的c(H+)=1×10-9mol/L,即此时溶液中的氢氧根离子浓度为1×10-9mol/L,然后结合水的离子积计算出溶液中氢离子浓度,再根据pH=-lgc(H+)计算出该溶液的pH.
解答 解:常温下,向水中加入了盐酸溶液后,盐酸中的氢离子抑制了水的电离,溶液中的氢氧根离子是水电离的,
则由水电离产生的c(H+)=1×10-9mol/L,即此时溶液中的氢氧根离子浓度为:c(OH-)=1×10-9mol/L,
常温下,水的离子积为1×10-14,则此时溶液中氢离子浓度为:$\frac{1×1{0}^{-14}}{1×1{0}^{-9}}$mol/L=1×10-5mol/L
该溶液中溶液的pH=-lgc(H+)=5,
故答案为:5.
点评 本题考查了溶液pH的计算,题目难度中等,明确向水中加入了盐酸溶液后,溶液中的氢氧根离子是水电离的为解答关键,注意掌握溶液酸碱性与溶液pH的关系.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
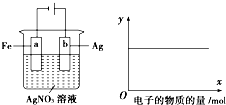 按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )
按图实验,若x轴表示流入阴极电子的物质的量,则y轴可表示①c(Ag+) ②c(NO3-)③a棒的质量④b棒的质量( )| A. | ①③ | B. | ③④ | C. | ①②④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
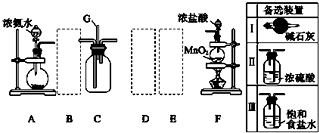 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
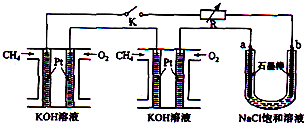
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用 NaHCO3 溶液可一次鉴别出稀盐酸、NaOH溶液、AlCl3溶液、NaAlO2 溶液 | |
| B. | 高锰酸钾试剂瓶内壁上黑色物质可用稀盐酸洗涤 | |
| C. | 除去SO2 中少量HCl,将其通入饱和的Na2SO3 溶液 | |
| D. | 将硝酸铵晶体溶于水,测得水温下降,证明硝酸铵水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2Br$\stackrel{NaOH水溶液}{→}$CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| B. | CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| C. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{HBr}{→}$CH2BrCH3$\stackrel{Br_{2}}{→}$CH2BrCH2Br | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2=CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | A | B | CO | H2 |
| 燃烧热/kJ•mol-1 | 725 | 5 518 | 283 | 286 |
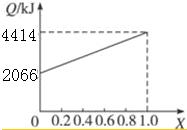
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com