
【题目】用单线桥法或者双线桥法表示下列氧化还原反应中电子转移的方向和数目,并按要求填空。
(1)(单线桥法) CuO+H2![]() Cu+H2O 被氧化的元素是_____________,
Cu+H2O 被氧化的元素是_____________,
(2)(单线桥法) 2KI+Cl2=2KCl+I2 发生氧化反应的物质是_____________,
(3)(双线桥法) 8NH3+3Cl2=N2+6NH4Cl 还原剂是_____________,
(4)(双线桥法) 2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被还原的元素是____。
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 常温常压下,35.5g的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5NA
B. 60g甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2NA
C. 标准状况下,2.24L PH3与3.4gH2S气体分子所含电子数目均为1.8NA
D. 已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol当该反应生成NA个NH3分子时,反应放出的热量小于46.2kJ
2NH3(g) △H= -92.4kJ/mol当该反应生成NA个NH3分子时,反应放出的热量小于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
a.98%的浓硫酸 b.1%的品红溶液 c.1.0 mol·L-1的KI-淀粉溶液
d.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度为_______mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列固体混合物与过量的稀H2SO4反应,能产生气泡并有沉淀生产的是 ( )
A. NaHCO3和Al(OH)3 B. BaCl2和NaCl
C. HClO3和K2SO4 D. Na2SO3和BaCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年世界环境日我国的主题是:改善环境质量,推动绿色发展。符合该主题的措施有( )
A. 燃煤烟气脱硫
B. 大力发展和使用清洁能源
C. 直接排放电镀废水
D. 在汽车尾气系统中装置催化转化器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入1molN2,右边充入CO和CO2的混合气体共8g时,隔板处于如图位置(左、右两侧温度相同)。右侧CO与CO2分子数之比为________________;
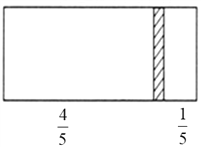
(2)已知质量分数为28%的氨水物质的量浓度为12 mol·L-l,则质量分数为14%的氨水物质的量浓度_____(填“大于”、“小于”或“等于”) 6 mol·L-l;已知4 mol·L-l 的硫酸溶液密度为![]() ,2 mol·L-l 的硫酸溶液密度为
,2 mol·L-l 的硫酸溶液密度为![]() 。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含
。100g浓度为4mol·L-l 的硫酸溶液与________mL水混合,使硫酸的物质的量浓度减小到2 mol·L-l 。(用含![]() 、
、![]() 的式子表示)
的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com