
【题目】下列厨房中常见物质,溶于水之后形成的溶液能产生丁达尔效应的是( )
A.纯碱B.食盐C.料酒D.鸡蛋清
科目:高中化学 来源: 题型:
【题目】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )

A. 逸出气体的体积:a电极的小于b电极的
B. a电极附近呈蓝色,b电极附近呈红色
C. a电极附近呈红色,b电极附近呈蓝色
D. 一电极逸出无味气体,另一电极逸出刺激性气味气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应(设H2SO4和Ba(OH)2溶液密度相同).试回答: 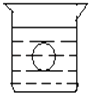
(1)此实验中,观察到的现象有:
①;② .
(2)写出实验过程中反应的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一种泉水,取0.5L这种泉水作为样品,经测定该样品中含有0.48g的Mg2+ . 那么,该泉水中Mg2+的物质的量的浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1mol/L NaOH溶液的体积是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.冰和水晶都是分子晶体
B.原子晶体一定是共价化合物
C.某物质固态时不导电但在熔融状态下能导电,则该物质中一定含有离子键
D.干冰是分子晶体,其溶于水生成碳酸的过程只需克服分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中充入1molH2和1molI2,压强为P(Pa),并在—定温度下使其发生反应:H2(g)+I2(g) ![]() 2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
2HI(g) △H<0。保持容器内气体压强不变,向其中加入1molN2,反应速率______(填“变大”、“ 变小”或“不变”),平衡_________ 移动(填“向正反应方向”、“ 向逆反应方向”或“不”)。
(2)火箭残骸中存在红棕色气体,原因为:N2O4![]() 2NO2(g) △H
2NO2(g) △H
①当温度升高时,气体颜色变深,则反应为_______________( “吸热”或“放热”)反应。
②T℃,将1molN2O4充入恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态是____________
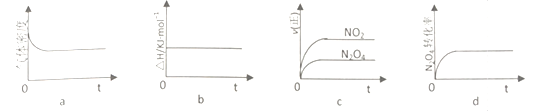
③T℃,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数___________(填“增大”“ 不变”或“减小”)。
(3)已知 4HCl(g)+O2(g) ![]() 2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
2Cl2 (g)+2H2O(g)中 2mol HCl被氧化,放出 57.8kJ 的热量,且部分化学键断裂示意图如下:
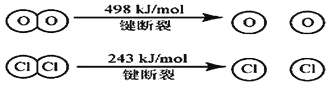
①写出该反应的热化学方程式___________________ 。
②断开1 mol H-O键与断开1 molH-C1键所需能量相差约为_________kJ,H2O中H-O键比HCl中H-Cl键___________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组将V1mL0.50mol/LH2SO4溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验装置和实验结果如下图所示(实验中始终保持V1 +V2=50mL)。回答下列问题:

(1)上图所示实验装置中有一个明显的错误________________。
(2)为了减少实验误差,实验过程中将NaOH溶液________________ (选填“一次”或“分多次”)倒入盛有稀硫酸的小烧杯中。溶液混合后,准确读取混合溶液的____________,记为终止温度。
(3)研究小组做该实验时环境温度________ 22°C(填“高于”、“ 低于”或“等于”),判断的依据是___________________。
(4)由题干及图形可知,V1:V2=_________时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为_________ mol/L。
(5)若通过实验测定及有关计算知此反应共放出a kJ的热量.请写出此反应的热化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
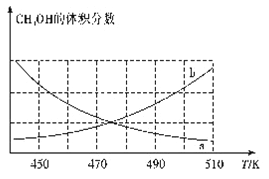
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com