
分析 由于硫酸是二元强酸,故25℃时,0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,根据pH=-lgc(H+)来计算;
由于氢氧化钠是一元强碱,故0.01mol•L-1 NaOH溶液c(OH-)=0.1mol/L,然后根据c(H+)=$\frac{Kw}{c(O{H}^{-})}$求出氢离子浓度,再根据pH=-lgc(H+)来计算.
解答 解:由于硫酸是二元强酸,故25℃时,0.05mol•L-1H2SO4溶液中c(H+)=0.1mol/L,故pH=-lgc(H+)=-lg0.1=1;
由于氢氧化钠是一元强碱,故0.01mol•L-1 NaOH溶液c(OH-)=0.1mol/L,故溶液中c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.01}$=10-12mol/L,故溶液的pH=-lgc(H+)=-lg10-12=12.
答:0.05mol/L的硫酸溶液的pH为1,0.01mol/L的氢氧化钠溶液的pH为12.
点评 本题考查了溶液pH的有关计算,应注意的是溶液的pH=-lgc(H+)公式的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )
W、X、Y、Z是原子序数依次增大的短周期元素.m、n、p是由这些元素组成的二元化合物,r是元素Y的常见单质,能使带火星的木条复燃,q的水溶液呈碱性,0.01mol•L-1s溶液的pH为12,q、s的焰色反应均呈黄色.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径:W<X<Y<Z | |
| B. | Y的氢化物的沸点比Z的氢化物的沸点高 | |
| C. | 通常状况下,X的氢化物可能呈气态、液态或固态 | |
| D. | 由W、X、Y、Z四种元素只能组成一种化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
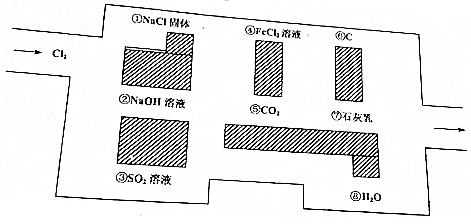
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ω=$\frac{w}{w+V}$×100% | B. | S=$\frac{w}{V}$×100g | ||
| C. | c=$\frac{1000w}{MV}$mol•L-1 | D. | c=$\frac{1000aw}{M(w+V)}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
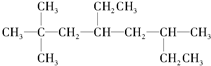 的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种.
的系统名称是2,2,6-三甲基-4-乙基辛烷,其一氯代物有10种.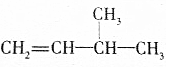 在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.
在催化剂存在下完全氢化,所得烷烃的系统名称是2-甲基丁烷.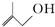 的分子式为C4H8O;
的分子式为C4H8O; 名称为:1,2-二甲基苯(或邻二甲苯).
名称为:1,2-二甲基苯(或邻二甲苯).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的晶体硅可以制备晶体管等半导体、电脑芯片和光导纤维 | |
| B. | PM 2.5是指大气中直径接近2.5×10-6m的颗粒物,它分散在空气中形成胶体 | |
| C. | 受强碱腐蚀致伤时,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗,并视情况作进一步处理 | |
| D. | NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com