
分析 (1)反应前盐酸浓度为5mol/L、反应后浓度为4.5mol/L,则浓度变化量=(5-4.5)mol/L=0.5mol/L,根据n=CV计算参加反应的盐酸的物质的量;
(2)Fe和HCl反应方程式为Fe+2HCl=FeCl2+H2↑,由Fe和HCl之间的关系式计算参加反应Fe的质量.
解答 解:(1)反应前盐酸浓度为5mol/L、反应后浓度为4.5mol/L,则浓度变化量=(5-4.5)mol/L=0.5mol/L,根据n=CV=0.5mol/L×0.2L=0.1mol,
答:反应中消耗硫酸的物质的量是0.1mol;
(2)Fe和HCl反应方程式为Fe+2HCl=FeCl2+H2↑,设参加反应的Fe质量为x,
Fe+2HCl=FeCl2+H2↑,
56g 2mol
x 0.1mol
$\frac{56}{x}=\frac{2}{0.1}$
x=2.8g
答:参加反应的Fe的质量为2.8g.
点评 本题考查化学方程式的计算,侧重考查计算能力,明确各个物理量的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应2Mg(s)+CO2(g)═C(s)+2MgO(s)能自发进行,则该反应的△H>0 | |
| B. | 电解法精炼铜时,粗铜作阳极,精铜作阴极 | |
| C. | 在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) | |
| D. | CH3COOH溶液加水稀释后,电离度增大,溶液中$\frac{C(C{H}_{3}CO{O}^{-})C({H}^{+})}{C(C{H}_{3}COOH)}$的值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
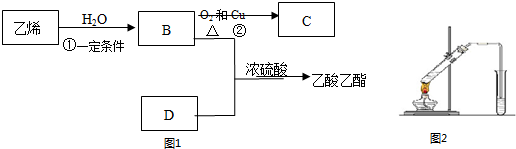
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com