
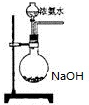
 氨在国民经济中占有重要地位.
氨在国民经济中占有重要地位. ,
, ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、Na2SO4=2Na++SO4-2 |
| B、Ba(OH)2=Ba2++(OH-)2 |
| C、KClO3=K++Cl-+3O2- |
| D、Fe2(SO4)3=2Fe3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用 | 无明显现象 |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤 | 有白色沉淀 |
| 步骤3:取少量步骤2得到的滤渣加入过量盐酸 | 滤渣不能完全溶解,说明酸雨中含有硫酸 |
| 步骤4:取适量步骤2得到的滤液, | |
| 步骤5:往B试管中加入 振荡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
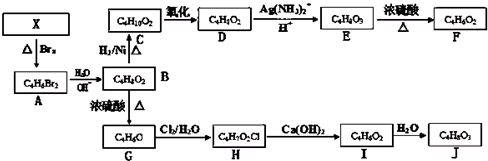
查看答案和解析>>
科目:高中化学 来源: 题型:
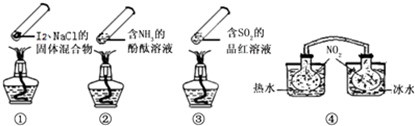
| A、加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B、加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C、④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D、四个“封管实验”中都有可逆反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
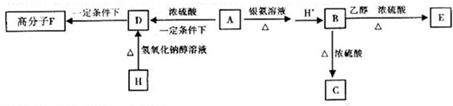
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | 2Na+2H2O=2NaOH+H2↑ 3NO2+H20=NO+2HNO3 | 均为水作氧化剂的氧化还原反应 |
| B | SiO2能与NaOH溶液反应也能与氢氟酸反应 Al2O3能与NaOH溶液反应,也能与盐酸反应 | 两种氧化物均为两性氧化物 |
| C | Cl2+2Br-=2Cl-+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | Cl2+2FeCl2=2FeCl3 I2+SO2+2H2O=H2SO4+2HI | 均属离子反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.
A、B、D、E、F、G是原子序数依次增大的六种短周期元素.A和B能形成B2A和B2A2两种化合物,B、D、G的最高价氧化物对应水化物两两之间都能反应,D、F、G原子最外层电子数之和等于15.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,PbSO4易溶于pH=7的CH3COONH4溶液,说明(CH3COO)2Pb是弱电解质 |
| B、向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,则Ksp(BaCO3)<Ksp(BaSO4) |
| C、潜艇上的核反应堆使用液态铝-钠合金作载热介质,若合金中n(Na)>n(Al),将其投入到足量的水中可得无色透明溶液 |
| D、向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀,说明KI3溶液中存在平衡:I3-═I2+I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com