
| 元素 | A | B | C | D | E |
| 相关 信息 | A元素原子核外有3个电子层,最外层有3个电子. | 与元素C可形成离子个数比 为2:1和1:1的化合物 | C元素的原子K、L层电子数之和比L、M层电子数之和多1个电子 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属, 人体缺少该元素易患贫血症 |
 、
、 .
.分析 A元素原子核外有3个电子层,最外层有3个电子,即A为Al元素,C原子的K、L层电子数之和比L、M层电子数之和多1个,则L层电子数为8,M层电子数为1,即C为Na元素,B与元素C可形成离子个数比为2:1和1:1的化合物,分别是氧化钠和过氧化钠,所以B元素是O,D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,所以D是硫元素,E的单质是用途最广泛的金属,人体缺少该元素易患贫血症,所以E是铁,由此分析解答.
解答 解:A元素原子核外有3个电子层,最外层有3个电子,即A为Al元素,C原子的K、L层电子数之和比L、M层电子数之和多1个,则L层电子数为8,M层电子数为1,即C为Na元素,B与元素C可形成离子个数比为2:1和1:1的化合物,分别是氧化钠和过氧化钠,所以B元素是O,D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,所以D是硫元素,E的单质是用途最广泛的金属,人体缺少该元素易患贫血症,所以E是铁,
(1)铁在元素周期表中的位置是第四周期第ⅤⅢ族元素,故答案为:第四周期第ⅤⅢ族;
(2)非金属性越强对应氢化物越稳定,所以水受热分解所需温度高,故答案为:H2O>H2S;
(3)氧化钠是离子化合物,由钠离子与氧离子构成,电子式为; ;过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为:
;过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: ,故答案为:
,故答案为: ;
; ;
;
(4)D为S元素,其两种氧化物为SO2、SO3,二氧化硫具有漂白性,能使品红溶液褪色,而三氧化硫不能,故用品红溶液鉴别,三价铁离子与硫氰根离子发生络合反应生成血红色硫氰合铁络合物,离子方程式为Fe3++3SCN-=Fe(SCN)3,取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+,
故答案为:品红;取少量溶液于试管中,加入KSCN溶液,若出现血红色溶液证明原溶液中含Fe3+;
(5)氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,离子方程式为:Al(OH)3+OH?=AlO2-+2H2O,故答案为:Al(OH)3+OH?=AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律的综合应用,难度不大,侧重学生对基础知识的巩固.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
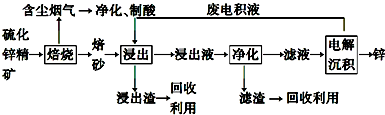
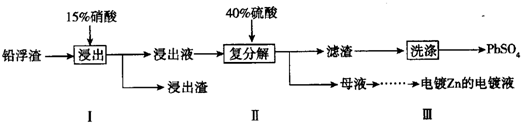
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
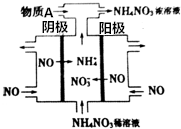 如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:
如图是利用N2H4-KOH-O2为电源点解NO制备NH4NO3,其工作原理如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精是用淀粉类植物经过发酵后蒸馏制得,浓度通常是75% | |
| B. | 为防止电池中的重金属污染土壤和水体,应将废电池深埋 | |
| C. | “海水淡化”可以解決“淡水供应危机”,向海水中加入明矾可以使海水淡化 | |
| D. | 小苏打是制作面包等糕点的膨松剂.也是胃溃疡病人的治疗药物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
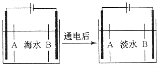 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
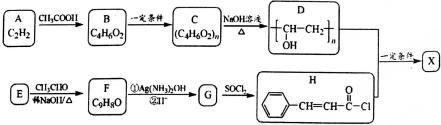
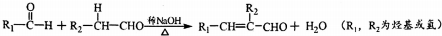
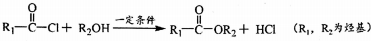
 .
.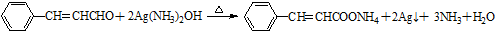 .
. .
.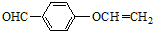 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
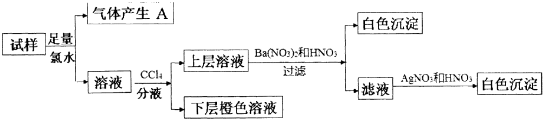
| A. | 气体A为CO2 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 原无色溶液中至少存在四种离子 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、Al3+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
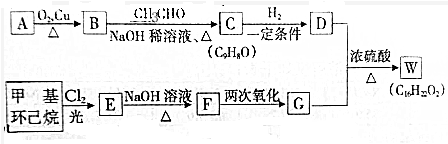
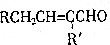 +H2O(R、R′为H或烃基)
+H2O(R、R′为H或烃基)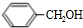 ;C中含有的官能团为碳碳双键、醛基(写名称).
;C中含有的官能团为碳碳双键、醛基(写名称).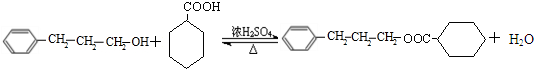 .
.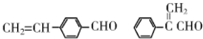 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com