
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜离子 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
分析 A.羊毛的成分为蛋白质,棉花、淀粉均为多糖;
B.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜;
C.△H-T△S<0的反应可自发进行;
D.滴加几滴醋酸,与漂白精反应生成具有漂白性的HClO.
解答 解:A.羊毛的成分为蛋白质,棉花、淀粉均为多糖,相对分子质量均在10000以上,属于天然高分子化合物,故A正确;
B.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜,把不溶性的硫化铜氧化,硫从负二价被氧化成正六价,故最后转化成可溶的硫酸铜,故B正确;
C.△H-T△S<0的反应可自发进行,则某反应的△H>0、△S<0,该反应可能正向进行,故C错误;
D.滴加几滴醋酸,与漂白精反应生成具有漂白性的HClO,则为加快漂白精的漂白速率,使用时可滴加几滴醋酸,故D正确;
故选C.
点评 本题考查较综合,涉及有机物的组成与性质、氧化还原反应、反应方向的判断、反应速率等,注重高频考点的考查,把握物质的性质、相关反应原理为解答的关键,综合性较强,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子键是指阴阳离子间的静电引力 | |
| B. | 离子化合物是指只含有离子键的化合物 | |
| C. | 升高温度只能使吸热反应的速率增大,不能使放热反应的速率增大 | |
| D. | 粉碎固体反应物可以增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
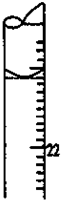 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 春节燃放爆竹对环境无污染 | |
| B. | “酸雨”是由大气中的碳、氮、硫的氧化物溶于雨水造成 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 光化学烟雾的产生与人为排放大气污染物氮氧化物无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有②③⑦ | C. | 只有①③⑥ | D. | 只有⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com