
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
分析 A.0.2 mol•L-1的NaHCO3溶液中碳酸氢根离子水解溶液显碱性;
B.NaN3水溶液中叠氮酸根离子水解溶液显碱性;
C.溶液中存在电荷守恒分析判断;
D.酸性大小为:CH3COOH>H2CO3>HClO,酸越弱酸根离子水解程度越大;
解答 解:A.0.2 mol•L-1的NaHCO3溶液中碳酸氢根离子水解溶液显碱性,溶液中离子浓度大小c(Na+)>c(HCO3-)>c(OH-)>c(H+),故A正确;
B.NaN3水溶液中叠氮酸根离子水解溶液显碱性,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+),故B正确;
C.常温下向氨水中逐滴滴入盐酸至溶液的pH=7,c(OH-)=c(H+),溶液中存在电荷守恒分析,c(NH4+)+c(H+)=c(Cl-)+c(OH-);则混合液中c(NH4+)=c(Cl-),故C正确;
D.酸性大小为:CH3COOH>H2CO3>HClO,酸越弱酸根离子水解程度越大,常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)<c(NaHCO3)<c(CH3COONa),故D错误;
故选D.
点评 本题考查了电解质溶液中电离平衡、盐类水解、电解质溶液中电荷守恒、离子浓度大小比较,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
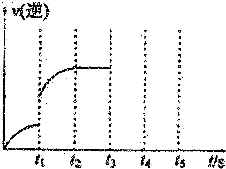 Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅰ.体积为5L的恒温、恒容密闭容器甲起始投入2molN2、3molH2经过l0s达平衡,测得平衡时NH3的物质的量为0.8mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O3 | B. | NO2 | C. | N2O | D. | N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
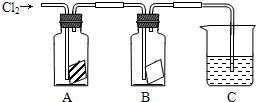
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com